Cu2+ - добавление щелочи КОН – выпадение голубого осадка Cu(OH)2
Fe2+ - добавление щелочи КОН – выпадение зеленого осадка Fe(OH)2 постепенно буреющего
Fe3+ - добавление щелочи КОН – выпадение бурого осадка Fe(OH)3
Pb2+ - добавление KI – выпадение золотистого осадка PbI2
Ag+ - добавление KCl или HCl – выпадение белого осадка AgCl, нерастворимого в кислотах
Ва2+ - добавление H2SO4 – выпадение белого осадка ВаSO4, нерастворимого в кислотах
Са2+ - добавление Na2CO3 – выпадение белого осадка СаCO3, который при добавлении кислоты растворяется и выделяется углекислый газ СО2
Zn2+ Al3+ - добавление щелочи КОН, при этом выпадает белый осадок, который растворяется при дальнейшем добавлении щелочи
NH4+ - добавление щелочи КОН – выделяется бесцветный газ аммиак NH3
SO42- - добавление BaCl2 при этом выпадает белый осадок ВаSO4, нерастворимый в кислотах
NO3- - добавление концентрированной серной кислоты, выделяется бурый газ NO2
S2- - добавление кислоты, выделяется газ с запахом тухлых яиц H2S, или добавить Pb(NO3)2, выпадет черный осадок PbS
SO32- - добавить кислоту, при этом выделиться бесцветный газ SO2
PO43- - добавить СaCl2 выпадет белый осадок Са3(РО4)2 или добавить AgNO3, выпадет желтый осадок Ag3 PO4
CO32- - добавить СaCl2 выпадение белого осадка СаCO3, который при добавлении кислоты растворяется и выделяется углекислый газ СО2
Или добавить кислоту и выделится газ СО2
SiO32- - добавить кислоту и выпадет белый осадок Н2SiO3
Cl- добавить AgNO3 выпадет белый осадок AgCl не растворимый в кислотах
Br- добавить AgNO3 выпадет желтоватый осадок AgBr не растворимый в кислотах
I- Добавить азотную кислоту, перекись водорода, перманганат калия или другой сильный окислитель, при этом выпадет фиолетовый осадок I2
Алканы, краткая характеристика и свойства. Метан
Алканы – это предельные углеводороды, общая молекулярная формула которых CnH2n+2
К алканам относится следующий ряд веществ (гомологический ряд):
| Молекулярная формула | Краткая структурная формула | название |
| СН4 | СН4 | метан |
| С2Н6 | СН3–СН3 | этан |
| С3Н8 | СН3–СН2–СН3 | пропан |
| С4Н10 | СН3–СН2–СН2–СН3 | бутан |
| С5Н12 | СН3–СН2–СН2–СН2–СН3 | пентан |
| С6Н14 | СН3–СН2–СН2–СН2–СН2–СН3 | гексан |
| С7Н16 | СН3–СН2–СН2–СН2–СН2–СН2–СН3 | гептан |
| С8Н18 | СН3–СН2–СН2–СН2–СН2–СН2–СН2–СН3 | октан |
| С9Н20 | СН3–СН2–СН2–СН2–СН2–СН2–СН2–СН2–СН3 | нонан |
| С10Н22 | СН3–СН2–СН2–СН2–СН2–СН2–СН2–СН2–СН2–СН3 | декан |
Метан – газ без цвета и запаха, легче воздуха, взрывоопасен, является предельным углеводородом, все связи одинарные, прочные, насыщенные,
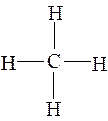
Валентность атома С во всех органических соединениях равна IV
Алканы вступают в реакции замещения с галогенами (хлором, бромом) на свету, также с азотной и серной кислотой, могут разлагаться с отщеплением водорода или разлагаться на две более мелких углеводорода (крекинг). Они не растворимы в воде, и поэтому с ней не реагируют
При горении в кислороде (на воздухе) образуют СО2 и воду
2С2Н6 + 7О2 = 4СО2 + 6Н2О
 2020-09-24
2020-09-24 124
124








