Настоящие методические указания составлены в соответствии со стандартом по физической химии для студентов технических высших учебных заведений по одному из разделов курса "Термодинамика", содержат краткое теоретическое введение и описание экспериментальной части работы
Цель работы: Исследование процесса экстрагирования, приобретение навыка экспериментального определения коэффициента распределения.
Распределение вещества между двумя ограниченно растворимыми жидкостями подчиняется закону распределения. Вещество, добавленное к системе, состоящей из двух нерастворимых жидкостей, распределяется между обеими фазами в определенном, постоянном при данной температуре отношении. Этот закон характеризует равновесное состояние системы и может быть выражен через коэффициент распределения как отношение молярных концентраций растворенного вещества в обеих фазах:

где c 1, c 2, - молярные концентрации растворенного вещества соответственно о верхней и нижней жидкой фазах; L - коэффициент распределения.
Насыщенный раствор малорастворимого вещества является разбавленным раствором и удовлетворительно подчиняется законам идеальных растворов. Указанное простейшее соотношение справедливо только тогда, когда растворяемое вещество в каждой из равновесных фаз находится в одинаковом молекулярном состоянии. Закон распределения не выполняется во всех случаях изменения состояния растворенных молекул хотя бы в одной из фаз системы. Такими изменениями могут быть диссоциация или ассоциация молекул растворенного вещества. В таком случае коэффициент распределения выражается уравнением:


где n - средняя молекулярная масса растворенного вещества во втором и первом растворителях
Коэффициент распределении есть величина постоянная, не зависящая от количества растворенного вещества, определяется только природой растворителей, растворенного вещества и температурой. Зависимость коэффициента распределения от температуры определяется уравнением:

где Т - абсолютная температура;
R - универсальная газовая постоянная;
Δ H - изменение энтальпии при переходе вещества из одной фазы в другую.
Самый распространенный пример применения закона распределения – экстрагирование, т.е. извлечение вещества из раствора другим растворителем, который не смешивается с первым и растворяет извлекаемое вещество в большем количестве, чем первый. Следует учитывать, что экстракцию выгоднее вести последовательно несколькими порциями экстрагирующего вещества, чем однократно таким же количеством растворителя, но одной порцией.
Пример.
Пусть в первой фазе объемом V растворена масса m0 вещества, подлежащего извлечению n порциями другого растворителя (экстрагента) объемом v каждая. Общий объем экстрагента V, (фаза 2). Коэффициент распределения равен L.
После первого экстрагирования в фазе 1 останется m1 неизвлеченного вещества, а в экстракт перейдет (m0-m1) растворенного вещества. Тогда

Следовательно, после первого экстрагирования в фазе 1 останется
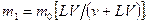
После второго экстрагирования в растворе останется m2 неизвлеченного вещества, а в экстракт перейдет (m1-m2) вещества, т.е.
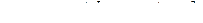
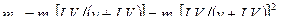
После n-ного экстрагирования в фазе 1 останется
 (1)
(1)
растворенного вещества, а всего будет извлечено

После однократного экстрагирования этого же вещества из данного раствора (фаза 1) вторым растворителем (фаза 2) общим объемом V2 = nv останется неизвлеченным
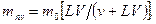 (2)
(2)
Из анализа (1) и (2) видно, что тnv > mn.
 2020-09-24
2020-09-24 761
761








