Студент получает у преподавателя один из следующих вариантов задания (см. табл.2).
Реакционный сосуд после определения постоянной калориметра несколько раз ополаскивают дистиллированной водой и пипеткой вносят в него 25 см3 кислоты, закрывают сосуд пробкой с мешалкой и термометром и производят 10 измерений температуры «предварительного периода» при равномерном перемешивании раствора. Через боковое ответвление реакционного сосуда вносят в него 25 см3 основания. При непрерывном перемешивании раствора производят измерения температуры в «главном» и «заключительном» периодах. Экспериментальные данные записывают в таблицу 1.
Таблица 1
| Электролиты (концентрация) | Температура, Т,°С | ||
| (предварительный период) | (главный период) | (заключительный период) | |
| KNO3 | 1. | 11. | 16. |
| 2. | 12. | 17. | |
| … | … | … | |
| 1. МеОН(0.5н) + +НА(0,5н) | 1. | 11. | 16. |
| 2. | 12. | 17. | |
| … | ... | … | |
| 2.... | |||
| 3.... | |||
Таблица 2
| Вариант | Задание | Вариант | Задание |
| 1. | NaOH + HCl (2н) | 9. | NaOH + HNO3 (0,5н) |
| NaOH + HAc (2н) | NH4OH + HNO3 (0,5н) | ||
| 2. | NaOH + HCl (1н) | 10. | KOH + HCl (2н) |
| NaOH + HAc (1н) | NH4OH + HCl (2н) | ||
| 3. | NaOH + HCl (0,5н) | 11. | KOH + HCl (1н) |
| NaOH + HAc (0,5н) | NH4OH + HCl (1н) | ||
| 4. | NaOH + H2SO4 (2н) | 12. | KOH + HCl (0,5н) |
| KOH + HAc (2н) | NH4OH + HCl (0,5н) | ||
| 5. | NaOH + H2SO4 (1н) | 13. | KOH + H2SO4 (2н) |
| KOH + HAc (1н) | NH4OH + H2SO4 (2н) | ||
| 6. | NaOH + H2SO4 (0,5н) | 14. | KOH + H2SO4 (1н) |
| KOH + HAc (0,5н) | NH4OH + H2SO4 (1н) | ||
| 7. | NaOH + HNO3 (2н) | 15. | KOH + H2SO4 (0,5н) |
| NH4OH + HNO3 (2н) | NH4OH + H2SO4 (0,5н) | ||
| 6. | NaOH + HNO3 (1н) | ||
| NH4OH + HNO3 (1н) |
 |
Обработка результатов
Рис.1. Зависимость изменения температуры во времени
На основании экспериментальных данных (табл.1) вычерчивают на миллиметровой бумаге график изменения температуры во времени (рис.1.). На рисунке АВ - предварительный, BD - главный, DE -заключительный периоды. Для графического определения точного значения ΔT проецируют точки В и D на ось ординат, находят середину отрезка BD и опускают перпендикуляр к оси ординат (сС). Продлевают линейные участки АВ и DE до пересечения с линией сС. Отрезок сс` соответствует изменению температуры ΔТ в калориметрическом опыте с учетом поправки на теплообмен.
Определим значение ΔТ для нитрата калия, вычисляют постоянную калориметра k по уравнению:
 ,
,
где ΔHраств(KNO3) - известная энтальпия растворения нитрата калия, равная 36,02 (при 29 1 К) или 34,93 (при 298K) кДж/моль; n - количество вещества нитрата калия, моль.
Определяют энтальпию нейтрализации (ΔНi) для раствора данной i-той молярной концентрации (сi) по уравнению
Δ Hi = k Δ T
 Вычислив энтальпию нейтрализации для данного количества кислоты или основания, рассчитывают интегральную энтальпию нейтрализации ΔHнейтр на один моль кислоты(основания).
Вычислив энтальпию нейтрализации для данного количества кислоты или основания, рассчитывают интегральную энтальпию нейтрализации ΔHнейтр на один моль кислоты(основания).
где 25 – объем раствора, см3.
Оценивают погрешность (П %) полученного значения энтальпии нейтрализации по отношению к табличному значению:

 Учитывая, что при образовании 1 моль воды из ионов водорода и гидроксида выделяется 55,9 кДж, по закону Гесса определяют теплоту диссоциации уксусной кислоты или гидроксида аммония.
Учитывая, что при образовании 1 моль воды из ионов водорода и гидроксида выделяется 55,9 кДж, по закону Гесса определяют теплоту диссоциации уксусной кислоты или гидроксида аммония.
Результаты вычислений записывают втабл.3
Таблица З
| Электролит | С,моль/л | Δ T, °C | Δ H, КДж | Δ Hнейтр , кДж/моль | 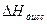 , кДж/моль , кДж/моль
|
| KNO3 | |||||
| NaOH+HCI | |||||
| NaOH+HAc | |||||
| (образец) |
Выводы
Исходя из экспериментальных и расчетных значений необходимо оценить силу изученных кислот и оснований, объяснить отклонение полученной экспериментально энтальпии нейтрализации от теоретической.
Коллоидная химия
 2020-09-24
2020-09-24 376
376








