Молярная концентрация – это количество вещества, содержащееся в 1 л раствора.
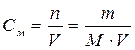 ,
,
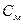 – молярная концентрация, моль/л;
– молярная концентрация, моль/л;
n – количество вещества, моль;
m – масса вещества, г;
M – молярная масса вещества, г/моль;
V – объем раствора, л.
Нормальная или эквивалентная концентрация – это количество молей эквивалентов, содержащихся в 1 л раствора.
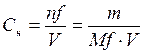 ,
,
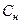 – нормальная или эквивалентная концентрация, моль/л;
– нормальная или эквивалентная концентрация, моль/л;
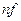 – количество вещества эквивалента, моль;
– количество вещества эквивалента, моль;
m – масса вещества, г;
M f – молярная масса эквивалента, г/моль;
V – объем раствора, л.
Процентная концентрация – это масса вещества, растворенная в 100 г раствора.
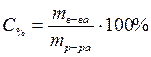 ,
,
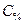 – процентная концентрация, %;
– процентная концентрация, %;
 – масса растворенного вещества, г;
– масса растворенного вещества, г;
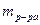 – масса раствора, г.
– масса раствора, г.
Титрование – это процесс постепенного добавления титранта к анализируемому раствору до точки эквивалентности.
Точка эквивалентности – это момент завершения титрования. Точка эквивалентности фиксируется с помощью индикаторов либо потенциометрически.
Эквивалент – это реальная или условная частица, эквивалентная 1 протону в кислотно-основной реакции или 1 электрону в окислительно-восстановительной.
Фактор эквивалентности – f – это число, показывающее какая доля реальной или условной частицы эквивалентна 1 протону в кислотно-основной реакции или 1 электроны в окислительно-восстановительной.
 , где z зависит от типа химического взаимодействия.
, где z зависит от типа химического взаимодействия.
Титрованный раствор (титрант, рабочий раствор) – это раствор с точно известной концентрацией. Готовят их либо растворением точной навески вещества, либо из фиксаналов.
Для приготовленных титрованных растворов вычисляют поправочный коэффициент (К) к молярности, представляющий собой отношение реально полученной концентрации титрованного раствора к теоретически заданной.
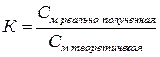
Коэффициент К должен находиться в пределах от 0,98 до 1,02. При отклонении величины К от указанных пределов растворы необходимо соответственно укрепить или разбавить, на основании следующих расчетов.
В случае разбавления раствора из величины К вычитают единицу и полученную разность умножают на 1000. Результат умножения соответствует количеству воды в мл, которое следует прибавить к каждому литру разбавляемого раствора.
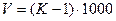
В случае укрепления из единицы вычитают К и разность умножают на количество г исходного вещества, взятого для приготовления 1 л раствора.
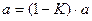
Полученное количество добавляют на каждый литр укрепляемого раствора. После этого раствор тщательно перемешивают. При определении поправочного коэффициента к титру производят не менее трех титрований.
Если результаты титрования отличаются друг от друга не более чем на 0,05 мл, берут среднее арифметическое из полученных данных. Если же расхождения между отдельными титрованиями превышают указанную величину, титрование необходимо повторить до получения требуемого результата. Чтобы ошибка при титровании не превышала ±0,1%, на титрование нужно расходовать не менее 20 – 30 мл раствора.
Отсчет производят по нижнему мениску, если жидкость бесцветная; если жидкость окрашена (например, раствор йода, раствор калия перманганата), отсчет производят по верхнему мениску.
В описании каждого титрованного раствора указывается теоретическое содержание химически чистого вещества в 1 мл раствора.
Титрованные растворы хранят при комнатной температуре, защищая их при необходимости от воздействия углекислоты и влаги воздуха и от прямых солнечных лучей.
При определении поправочного коэффициента необходимо пользоваться мерными колбами и пипетками, предварительно проверенными на правильность их калибровки.
Титр – это масса вещества в граммах, содержащаяся в 1 мл раствора.
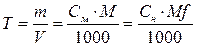 ,
,
Т – титр раствора, г/мл;
m – масса растворенного вещества, г;
V – объем раствора, л;
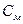 – молярная концентрация раствора, моль/л;
– молярная концентрация раствора, моль/л;
M – молярная масса растворенного вещества, г/моль;
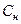 – нормальная концентрация раствора, моль/л;
– нормальная концентрация раствора, моль/л;
Mf – молярная масса эквивалента, г/моль.
Титр по определяемому веществу – это масса вещества в граммах, взаимодействующая с 1 мл титранта.
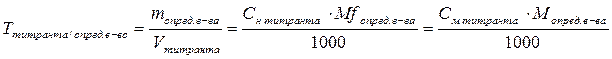
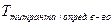 – титр титрованного раствора по определяемому веществу, г/мл;
– титр титрованного раствора по определяемому веществу, г/мл;
m – масса анализируемого вещества, г;
V – объем титрованного раствора, л;
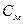 – молярная концентрация титрованного раствора, моль/л;
– молярная концентрация титрованного раствора, моль/л;
M – молярная масса анализируемого вещества, г/моль;
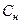 – нормальная концентрация титрованного раствора, моль/л;
– нормальная концентрация титрованного раствора, моль/л;
Mf – молярная масса эквивалента анализируемого вещества, г/моль.
 2020-09-24
2020-09-24 229
229








