Назва ЛПЗ
Штамп ЛПЗ
Рецепт
(дитячий, дорослий – потрібне підкреслити)
„____”________________20__ р.
Прізвище, ініціали хворого ________________________
Вік хворого _____________________________________
Прізвище, ініціали лікаря _________________________
Rp.: Sol. Zinci sulfatis 0,25% 20 ml
D.S. По 1 краплі в обидва ока 3 рази на добу
Органолептичний контроль: розчин прозорий, механічні включення відсутні.
Фізичний контроль: Vфактичний = 19,8 мл
Згідно з наказом МОЗ України №812 від 17.10.2012р. норма відхилення в загальному об’ємі даної лікарської форми становить + 8%.
Абсолютна помилка: 20,0 - 19,8 = 0,2 мл
Відносна помилка:
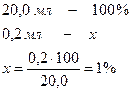
Хімічний контроль:
Ідентифікація: (методика, рівняння відповідних хімічних реакцій)
1. До 1-2 крапель розчину додають 2 краплі розчину калію фероціаніду, утворюється білий осад (реакція на катіон Zn2+):
3ZnSO4 + 2K4[Fe(CN)6] → K2Zn3[Fe(CN)6]2↓ + 3K2SO4
3Zn2+ + 2K+ + 2[Fe(CN)6]4- → K2Zn3[Fe(CN)6]2↓
2. До 2 крапель розчину додають 3 краплі розчину барію хлориду; утворюється білий осад (реакція на йони SO42-)
ZnSO4 + BaCl2 → BaSO4↓ + ZnCl2
Ba2+ + SO42- → BaSO4↓
Кількісне визначення:
Метод - комплексонометрія
Спосіб - пряме титрування
Методика: до 1,00 мл розчину, що досліджується, додають 3 мл аміачного буферного розчину, індикатор кислотний хромовий чорний спеціальний та титрують 0,05М розчином натрію едетату до синього забарвлення.
Рівняння реакцій:
Zn2+ + HІnd2- ⇄ [ZnInd]- + H+
синій винно-червоний
NH3 + Н+ ⇄ NH4+
Zn2+ + HY3- ⇄ [ZnY]2- + H+
[ZnInd]- + HY3- ⇄ [ZnY]2- + HІnd2-
винно-червоний синій
fекв(ZnSO4) = 1; Мекв = fекв. Мм; Мекв(ZnSO4.7Н2О)= 1. 287,54 = 287,54 г/моль
 .
.
Як відомо, кількісний експрес-аналіз передбачає швидке виконання аналізу і мінімальну витрату аналізованих об'єктів і реактивів. Для виконання кількісного аналізу намагаються брати такі наважки досліджуваних речовин (лікарських засобів), щоб об’єм титранту не перевищував 2 мл. В більшості випадків для аналізу відбирають 1-2 мл рідкої лікарської форми або 0,05 г порошку. Тому розрахуємо об’єм титранту, що повинен піти на титрування 1,00 мл даного лікарського засобу:
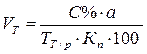 ;
; 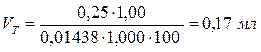 .
.
Розрахований об’єм титранту не перевищує прийнятої в експрес-аналізі норми (не більше 2 мл титранту). Отже, для титрування необхідно використовувати градуйовану піпетку на 1 мл.
Для розрахунку наважки лікарської форми на бажаний об’єм титранту використовують формули:
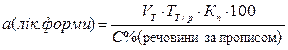 або
або 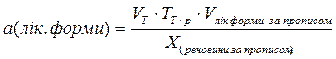 ,
,
де
Х(речовини за прописом) – грамовий вміст речовини за прописом.
Розрахунок відсоткового та грамового вмісту речовини, що визначається, в лікарській формі за результатами титрування:
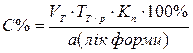 ,
, 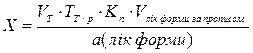 .
.
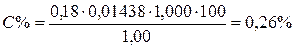
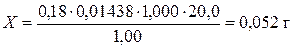
Порівняння одержаних результатів грамового вмісту речовини з відповідною нормою відхилення згідно з наказом МОЗ України №812 від 17.10.2012р.
Абсолютна похибка: 0,052 – 0,05 = 0,002 г;
Відносна похибка:

Згідно з наказом МОЗ України №812 від 17.10.2012р. норма відхилення в масі інгредієнту в даній лікарській формі не повинні перевищувати ±15%.
Висновок: очні краплі виготовлені задовільно.
Аналіз провів (провела) ПІБ, власний підпис.
| Додаток 8 до Правил виробництва (виготовлення) та контролю якості лікарських засобів в аптеках |
ДОПУСТИМІ НОРМИ
відхилень для лікарських засобів, виготовлених в аптеці
1. Для парентеральних лікарських засобів
| Відхилення, допустимі в масі наважки окремих лікарських речовин у рідких лікарських формах при виготовленні масо-об’ємним способом | |
| прописана маса, г | відхилення, % |
| До 0,02 | ±20 |
| Від 0,02 до 0,1 | ±15 |
| Від 0,1 до 0,2 | ±10 |
| Від 0,2 до 0,5 | ±8 |
| Від 0,5 до 0,8 | ±7 |
| Від 0,8 до 1,0 | ±6 |
| Від 1,0 до 2,0 | ±5 |
| Від 2,0 до 5,0 | ±4 |
| Понад 5,0 | ±3 |
| Відхилення, допустимі в загальному об’ємі рідких лікарських форм при виготовленні масо-об’ємним способом | |
| прописаний об’єм, мл | відхилення, % |
| До 10 | ±10 |
| Від 10 до 20 | ±8 |
| Від 20 до 50 | ±4 |
| Від 50 до 150 | ±3 |
| Від 150 до 200 | ±2 |
| Понад 200 | ±1 |
| Відхилення, допустимі при фасуванні рідких лікарських форм за об’ємом | |
| виміряний об’єм, мл | відхилення, % |
| До 5 | ±8 |
| Від 5 до 25 | ±5 |
| Від 25 до 100 | ±3 |
| Від 100 до 300 | ±1,5 |
| Від 300 до 1000 | ±1 |
| Понад 1000 | ±0,5 |
2. Для очних лікарських засобів
| Відхилення, допустимі в масі окремих лікарських речовин у рідких лікарських формах при виготовленні масо-об’ємним способом | |
| прописана маса, г | відхилення, % |
| До 0,02 | ±20 |
| Від 0,02 до 0,1 | ±15 |
| Від 0,1 до 0,2 | ±10 |
| Від 0,2 до 0,5 | ±8 |
| Від 0,5 до 0,8 | ±7 |
| Від 0,8 до 1,0 | ±6 |
| Від 1,0 до 2,0 | ±5 |
| Від 2,0 до 5,0 | ±4 |
| Понад 5,0 | ±3 |
| Відхилення, допустимі в загальному об’ємі рідких лікарських форм при виготовленні масо-об’ємним способом | |
| прописаний об’єм, мл | відхилення, % |
| До 10 | ±10 |
| Від 10 до 20 | ±8 |
| Від 20 до 50 | ±4 |
| Від 50 до 150 | ±3 |
| Від 150 до 200 | ±2 |
| Понад 200 | ±1 |
| Відхилення, допустимі в загальній масі мазей | |
| прописана маса, г | відхилення, % |
| До 5 | ±15 |
| Від 5 до 10 | ±10 |
| Від 10 до 20 | ±8 |
| Від 20 до 30 | ±7 |
| Від 30 до 50 | ±5 |
| Від 50 до 100 | ±3 |
| Понад 100 | ±3 |
3. Для твердих лікарських засобів
| Відхилення, допустимі при розважуванні порошків на дози | |
| прописана маса, г | відхилення, % |
| До 0,1 | ±15 |
| Від 0,1 до 0,3 | ±10 |
| Від 0,3 до 1 | ±5 |
| Від 1 до 10 | ±3 |
| Від 10 до 100 | ±3 |
| Від 100 до 250 | ±2 |
| Понад 250 | ±0,3 |
| Відхилення, допустимі в масі окремих інгредієнтів у порошках | |
| прописана маса, г | відхилення, % |
| До 0,02 | ±20 |
| Від 0,02 до 0,05 | ±15 |
| Від 0,05 до 0,2 | ±10 |
| Від 0,2 до 0,3 | ±8 |
| Від 0,3 до 0,5 | ±6 |
| Від 0,5 до 1,0 | ±5 |
| Від 1,0 до 2,0 | ±4 |
| Від 2,0 до 5,0 | ±3 |
| Від 5,0 до 10,0 | ±2 |
| Понад 10,0 | ±1 |
4. Для рідких лікарських засобів
| Відхилення, допустимі в загальному об'ємі рідких лікарських форм при виготовленні масо-об'ємним способом | |
| прописаний об'єм, мл | відхилення, % |
| До 10 | ±10 |
| Від 10 до 20 | ±8 |
| Від 20 до 50 | ±4 |
| Від 50 до 150 | ±3 |
| Від 150 до 200 | ±2 |
| Понад 200 | ±1 |
| Відхилення, допустимі в загальній масі рідких лікарських форм при виготовленні масо-об’ємним способом | |
| прописана маса, г | відхилення, % |
| До 10 | ±10 |
| Від 10 до 20 | ±8 |
| Від 20 до 50 | ±5 |
| Від 50 до 150 | ±3 |
| Від 150 до 200 | ±2 |
| Понад 200 | ±1 |
| Відхилення, допустимі в масі окремих інгредієнтів у рідких лікарських формах при виготовленні масо-об'ємним способом | |
| прописана маса, г | відхилення, % |
| До 0,02 | ±20 |
| Від 0,02 до 0,1 | ±15 |
| Від 0,1 до 0,2 | ±10 |
| Від 0,2 до 0,5 | ±8 |
| Від 0,5 до 0,8 | ±7 |
| Від 0,8 до 1,0 | ±7 |
| Від 1,0 до 2,0 | ±6 |
| Від 2,0 до 5,0 | ±5 |
| Понад 5,0 | ±3 |
| Відхилення, допустимі в масі окремих інгредієнтів у рідких лікарських формах при виготовленні масовим способом | |
| прописана маса, г | відхилення, % |
| До 0,1 | ±20 |
| Від 0,1 до 0,2 | ±15 |
| Від 0,2 до 0,3 | ±12 |
| Від 0,3 до 0,5 | ±10 |
| Від 0,5 до 0,8 | ±8 |
| Від 0,8 до 1,0 | ±7 |
| Від 1,0 до 2,0 | ±6 |
| Від 2,0 до 10,0 | ±5 |
| Понад 10,0 | ±3 |
Контроль якості концентрованих розчинів здійснюють відповідно до ДФУ та нормативних документів.
Для концентрованих розчинів ознаками непридатності є зміна кольору, помутніння, поява нальоту.
Відхилення, допустимі у масі окремих інгредієнтів у концентрованих розчинах: при вмісті речовини до 20 % включно - не більше ± 2 %, а при вмісті речовини понад 20 % - не більше ±1 % від зазначеного відсотка.
5. Для м’яких лікарських засобів
| Відхилення, допустимі в загальній масі мазей | |
| прописана маса, г | відхилення, % |
| До 5 | ±15 |
| Від 5 до 10 | ±10 |
| Від 10 до 20 | ±8 |
| Від 20 до 30 | ±7 |
| Від 30 до 50 | ±5 |
| Від 50 до 100 | ±3 |
| Понад 100 | ±2 |
| Відхилення, допустимі в масі окремих інгредієнтів у мазях | |
| прописана маса, г | відхилення, % |
| До 0,1 | ±20 |
| Від 0,1 до 0,2 | ±15 |
| Від 0,2 до 0,3 | ±12 |
| Від 0,3 до 0,5 | ±10 |
| Від 0,5 до 0,8 | ±8 |
| Від 0,8 до 1,0 | ±7 |
| Від 1,0 до 2,0 | ±6 |
| Від 2,0 до 10,0 | ±5 |
| Понад 10,0 | ±3 |
| Додаток 1 до Правил виробництва (виготовлення) та контролю якості лікарських засобів в аптеках |
ЖУРНАЛ
реєстрації результатів контролю води очищеної “in bulk”, води очищеної в контейнерах та води для ін’єкцій “in bulk”
| Дата отримання | Дата контролю | № з/п (№ аналізу) | № ба лона або бюретки | Результати контролю на відсутність домішок | Питома електропровідність | Висновок (задовільно або незадовільно) згідно з ДФУ | Підпис особи, яка про вела перевірку | |||||||||||
| нітрати | алюміній | важкі метали | вміст загального органічного вуглецю або “речовин, що окиснюються” | хлориди | сульфати | амонію солі | кальцій і магній | кислотність або лужність | ||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | |||
|
|
| |||||||||||||||||
| Додаток 2 до Правил виробництва (виготовлення) та контролю якості лікарських засобів в аптеках |
ЖУРНАЛ
реєстрації результатів контролю води для ін’єкцій стерильної
| Дата отримання | Дата контролю | № з/п (№ аналізу) | № балона або бюретки | Результати контролю на відсутність домішок | Питома електропровідність | Висновок (задовільно або незадовільно) згідно з ДФУ | Підпис особи, яка провела перевірку | ||||||||||||
| нітрати | алюміній | важкі метали | вміст загального органічного вуглецю або «речовин, що окиснються” | хлориди | сульфати | амонію солі | кальцій і магній | кислотність або лужність | механічні включення | ||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | |||
| __________ |
| ||||||||||||||||||
| Додаток 3 до Правил виробництва (виготовлення) та контролю якості лікарських засобів в аптеках |
ЖУРНАЛ
реєстрації окремих стадій виробництва (виготовлення) ін’єкційних, внутрішньовенних, інфузійних
та очних лікарських засобів*
| Дата | № з/п (№ серії або № рецепта) | Серія вихідної сировини | Вихідні лікарські засоби | Готовий продукт | Підпис особи, що виготовила розчини | Фасування | Підпис особи, що розфасувала | |||
| найменування | кількість | найменування | кількість | об’єм | кількість флаконів | |||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
__________
*Дозволяється реєстрація протягом дня на окремому аркуші за цією формою з подальшим брошуруванням або ведення окремих журналів для окремих стадій виробництва (виготовлення) ін’єкційних розчинів. Реєстрація виробництва (виготовлення) ін’єкційних розчинів проводиться в міру їх виробництва (виготовлення).
| Додаток 4 до Правил виробництва (виготовлення) та контролю якості лікарських засобів в аптеках |
ЖУРНАЛ
реєстрації ідентифікації лікарських засобів*
| Дата | № з/п (№ аналізу) | Найменування | № серії або аналізу заводу-виробника або сертифіката аналізу лабораторії | № заповненого штанглаcа | Речовина, що визначається (іон) | Результат контролю (+) або (-) | Підпис** | |
| особи, яка заповнила штанглас | особи, яка провела перевірку | |||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
__________
* За цією формою реєструються також результати контролю та ідентичність розчинів у бюретковій установці.
** Дата та підписи осіб, які заповнили та перевірили, проставляються також і на штангласі.
| Додаток 5 до Правил виробництва (виготовлення) та контролю якості лікарських засобів в аптеках |
ЖУРНАЛ
реєстрації стерилізації ін’єкційних та внутрішньовенних інфузійних лікарських засобів*
| Дата | № автоклава | № рецепта або серії | Найменування лікарського засобу, об’єм | Умови стерилізації | Термотест | Кількість флаконів | Підписи осіб, що перевіряли | № аналізу | Кількість флаконів готової продукції для відпуску | Підпис особи, що допустила лікарську форму до відпуску** | ||||
| температура | час (від і до) | до стерилізації | після стерилізації | стерилізацію | механічні домішки | до стерилізації | після стерилізації | |||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
__________
* Номери аналізів до і після стерилізації зазначаються через дріб.
** Для цього призначається окрема особа (зав. відділом, заст. зав. відділом, провізор-аналітик або провізор).
| Додаток 6 до Правил виробництва (виготовлення) та контролю якості лікарських засобів в аптеках |
ЖУРНАЛ
реєстрації стерилізації лікарських засобів, допоміжних матеріалів, посуду тощо*
| Дата | № з/п | №№ рецептів (вимог, серій) | Найменування лікарського засобу, допоміжного матеріалу, посуду тощо | Кількість | Умови стерилізації | Термотест | Підпис особи, яка провела перевірку | ||
| до стерилізації | після стерилізації | температура | час** | ||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
__________
* У журналі реєструються результати стерилізації лікарських засобів (за винятком ін'єкційних та внутрішньовенних інфузійних лікарських засобів), допоміжних матеріалів, засобів малої механізації, посуду тощо, а також робиться відмітка про прожарювання натрію хлориду (параметри прожарювання натрію хлориду - 180°С протягом двох годин, термін використання - 1 доба).
** Зазначається час початку та закінчення стерилізації.
| Додаток 7 до Правил виробництва (виготовлення) та контролю якості лікарських засобів в аптеках |
ЖУРНАЛ
реєстрації результатів контролю лікарських засобів, вироблених (виготовлених) в аптеці, внутрішньоаптечної заготовки, етилового спирту-1
| Дата | № з/п | № рецепта (вимоги), серія фасування-2, | № серії продукції | Склад лікарського | Речовина, що визначає-ться-4 (іон), об'єм, вага, однорідність змішування | Результати контролю | Прізвище особи, яка виробила (виготовила) та/або розфасувала | Висновок (задовільно або незадо-вільно)-5 | Підпис особи, яка провела перевірку | |||
| фізичного, органолептичного | рН (кислотність або лужність) | ідентифікація (+) чи (-) | кількісного (формула розрахунку, показник заломлення) | |||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
__________
-1 - При великому обсязі роботи за цією формою дозволяється вести окремі журнали з урахуванням специфіки. За цією формою реєструються також результати контролю на ідентичність розчинів у бюретковій системі.
-2 - Номер серії фасування переноситься з книги обліку лабораторних і фасувальних робіт.
-3 - Заповнюється при проведенні хімічного контролю.
-4 - Заповнюється при проведенні випробувань “Ідентифікація”.
-5 - Незадовільні результати підкреслюються червоним.
Додаток №3
ЗРАЗОК ТИТУЛЬНОГО АРКУША КУРСОВОЇ РОБОТИ
Міністерство охорони здоров’я України
Запорізький державний медичний університет
Кафедра фармацевтичної хімії
«Аналіз лікарської форми комбінованими методами»
 2020-09-24
2020-09-24 109
109








