В. Оствальд в 1888 г. применил к диссоциации слабых электролитов закон действующих масс.
В результате было выведено соотношение между константой равновесия (КС) и степенью диссоциации электролита (α) — закон разбавления Оствальда.
При растворении слабого бинарного электролита типа KtAn с концентрацией с в воде равновесные концентрации Kt+ и Аn- равна αC. Равновесная концентрация недиссоциированного электролита равна C(1 — α ).
| KtAn D Kt+ + An- | |||
| Исходная концентрация | C | 0 | 0 |
| Равновесная концентрация | C(1 - α ) | α С | α С |
Выражение константы равновесия этого обратимого процесса имеет вид
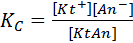 (1)
(1)
Подставив в выражение (1) равновесные концентрации, получим
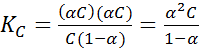 (2)
(2)
Для растворов слабых электролитов в области умеренных концентраций степень диссоциации мала (α < 0,01), и ее значением в знаменателе можно пренебречь. После преобразования уравнения (2) получаем
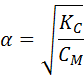
 2020-09-24
2020-09-24 121
121








