Будучи слабым электролитом, вода способна к самопроизвольной ионизации:
2Н2О(ж) D Н3О+ + ОН-
или упрощенно Н2О(ж) D Н+ + ОН-.
Константа равновесия процесса диссоциации воды, как и для любой равновесного процесса, может быть представлена в виде
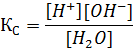
Рассмотренное выше равновесие смещено в сторону недиссоциированных молекул воды, что позволяет считать концентрацию воды величиной постоянной
КC = [Н2O] = [Н+][OH-].
Произведение постоянных величин Кс∙[Н2O] называется ионным произведением (или константой ионизации) воды и обозначается 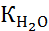 .
.
С увеличением температуры ионное произведение воды возрастает (см. табл.).
Зависимость ионного произведения воды от температуры
| Т,°С | 0 | 10 | 20 | 25 | 30 | 40 | 60 |
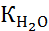 ∙ 10-14 ∙ 10-14
| 0,12 | 0,29 | 0,68 | 1,0 | 1,47 | 2,95 | 9,5 |
При 25°С величина 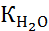 равна 1,0∙10-14, т.е.
равна 1,0∙10-14, т.е.
[Н+][ОН-] = 10-14. (4)
Логарифмируя левую и правую часть уравнения (4), получаем
lg[H+][OH-] = lg10-14.
После преобразования (логарифм произведения равен сумме логарифмов):
lg[H+] + lg[OH-] = -14, или -lg[H+] – lg[OH-] = 14.
Величина -lg[H+] называется водородным показателем (pH), a -lg[OH-] гидроксидным показателем (рОН). После преобразования получаем
pH + рОН = 14.
Для получения более точных значений pH и рОН в растворах с достаточно высокой концентрацией ионов вместо молярных концентраций следует использовать значения активностей ионов водорода или гидроксид-иона.
Водородный показатель равен отрицательному десятичному логарифму концентрации ионов водорода в водном растворе и характеризует степень кислотности (щелочности) раствора.
В нейтральном растворе при 25°С pH = 7, в кислом pH < 7, в щелочном pH > 7.
Лабораторная работа №4 Ф.И.О. ________________
группа __________________
 2020-09-24
2020-09-24 148
148








