Из протолитической теории Брёнстеда — Лоури следует, что чем сильнее основание, тем слабее сопряженная с ним кислота, и наоборот. Рассмотрим этот вывод на примере реакции нейтрализации.
Реакция нейтрализации — это реакция, протекающая между растворами кислоты и основания. Рассмотрим процесс нейтрализации слабой кислоты слабым основанием:
CH3COOH + NH3 D CH3COO- + NH4+
Количественной характеристикой этого процесса является константа нейтрализации
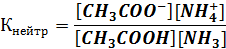
Умножив и числитель, и знаменатель дроби на [Н+], получим
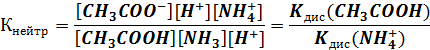
Таким образом, глубина протекания реакции нейтрализации определяется соотношением по силе исходной и образующейся кислот.
Нейтрализация сильной кислоты сильным основанием выражается уравнением
Н+ + ОН- D Н2O
и представляет собой реакцию, обратную самоионизации воды. Поскольку в стандартных условиях K(H2O) равна 1,0 10-14, то константа нейтрализации равна
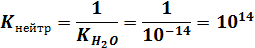
Таким образом, в стандартных условиях реакции между сильными кислотами и основаниями можно считать практически необратимыми.
Реакции гидролиза солей
Гидролиз солей относится к обменным реакциям, в которых одним из реагентов является вода. Суть гидролиза заключается во взаимодействии аниона слабой кислоты или катиона слабого основания с молекулами воды. Отсюда следует, что гидролизу подвергаются не растворенные соли, а лишь определенные ионы, входящие в их состав. Эти ионы должны соответствовать или слабым кислотам, или слабым основаниям Брёнстеда.
 2020-09-24
2020-09-24 126
126








