(редокс-потенциал).
Если пластинку из инертного металла (например, платины) опустить в раствор, содержащий одновременно и окисленную, и восстановленную форму вещества, то пластинка будет выступать в качестве переносчика электронов. В растворе установится равновесие между окисленной и восстановленной формами, а на пластинке возникнет окислительно-восстановительный потенциал. Рассчитать величину этого потенциала можно с помощью уравнения Нернста — Петерса, в котором под знаком логарифма находится выражение, обратное выражению для константы равновесия процесса восстановления. Рассмотрим несколько примеров.
Пример 7.5.
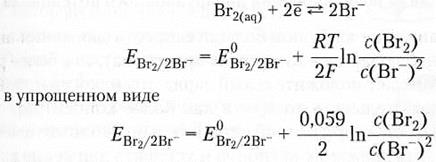
Пример 7.6.

или в упрощенном виде при температуре 25°С

Преобразование этого уравнения позволяет выразить зависимость редокс-потенциала потенциала от значения pH среды:
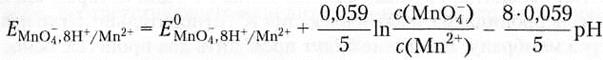
Анализируя примеры 5 и 6, можно сделать вывод о значительном влиянии среды на величину редокс-потенциала.
Если в полуреакции не участвуют ионы Н+ или ОН-, то величина восстановительного потенциала не зависит от кислотности среды; если они принимают участие в процессе восстановления, то величина этого потенциала будет уменьшаться или увеличиваться с изменением pH раствора.
Для характеристики биологических окислительно-восстановительных процессов используется стандартный биологический редокс-потенциал (Е°), рассчитываемый для температуры 25 или 37°С (298 или 310 К) и при pH = 7 (концентрации окисленной и восстановленной форм 1 моль/л).
 2020-09-24
2020-09-24 78
78








