При использовании данного метода нет необходимости определять степени окисления элементов. Для составления баланса достаточно знать заряды ионов, участвующих в реакции. Если реакция протекает в кислой среде, то для уравнивания полуреакций используют ионы Н+ и молекулы воды, если в щелочной — ионы ОН- и молекулы воды, а если в нейтральной — молекулы воды и ионы Н+ или ОН-.
Для уравнивания реакций методом электронно-ионного баланса необходимо выполнить следующую последовательность операций:
• найти молекулы и ионы, участвующие в окислительно-восстановительном процессе;
• написать полуреакции окисления и восстановления в ионно-молекулярном виде, рассчитывая число переносимых электронов по разности суммарного заряда частиц в левой и в правой части полуреакции;
• уравнять число отданных и полученных электронов, умножив эти полуреакции на соответствующие множители;
• написать суммарное уравнение в ионном виде и сократить соответствующее число одинаковых молекул и ионов в левой и правой части уравнения;
• перенести коэффициенты в уравнение реакции.
Удобство этого метода заключается в том, что можно получать коэффициенты практически для всех веществ, участвующих в реакции.
Уравняем реакции, приведенные выше в примерах 8.1 и 8.2, методом электронно-ионного баланса.
Пример 7.3.
КМnO4 + FeSO4 + H2SO4 → MnSO4 + Fe2(SO4)3 + K2SO4 + H2O
MnO4 + 2Fe2+ +... → Mn2+ + 2Fe3+ +...
(участники окислительно-восстановительного процесса)
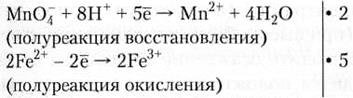
2MnO4 + 10Fe2+ + 16Н+ → 2Mn2+ + 10Fe3+ + 8Н2О
(суммарная реакция в ионном виде)
2КМnO4 + 10FeSO4 + 8H2SO4 → 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O
(окончательное уравнение реакции)
Пример 7.4.
3H2O2 + 2КМnO4 → 2МnO2 + 2КОН + 3O2 + 2Н2O
Н2O2 + МnO4- +... → МnO2 + O2 +...
(участники окислительно-восстановительного процесса)
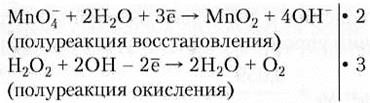
2MnO4- + 4Н2O + 3Н2O2 + 6ОН- → 2MnO2 + 8OН- + 6Н2O + 3O2
(суммарная реакция в ионном виде)
2MnO4- + 3Н2O2 → 2 MnO2 + 2 OН- + 2 Н2O + 3O2
(суммарная реакция в ионном виде после сокращения числа одинаковых частиц справа и слева)
3H2O2 + 2КМnO4 → 2МnO2 + 2КОН + 3O2 + 2Н2O
(окончательное уравнение реакции)
Обратите внимание, что при обозначении степени окисления сначала ставится знак «+» или «-», а затем цифра; при обозначении иона в растворе — наоборот.
 2020-09-24
2020-09-24 121
121








