Если пластинку металла погрузить в воду или в раствор его соли, то некоторое количество ионов металла с поверхности перейдет в раствор или из раствора на поверхность металла. Этот процесс будет сопровождаться гидратацией ионов.
Me D Меz+ + z e
Mez+ + n Н2O D [Ме(Н2O)n]z+
Таким образом на границе металл — раствор устанавливается равновесие
Me + n Н2O D [Ме(Н2O)n]z+ + z e
Пластинка металла при этом заряжается отрицательно или положительно. Например, в том случае, когда ионы металла уходят с пластинки, положительно заряженные ионы концентрируются у поверхности за счет сил электростатического притяжения, в результате чего образуется двойной электрический слой, и на границе металл — раствор возникает скачок электрического потенциала, который называется электродным потенциалом.
 Величина этого потенциала зависит от природы металла, концентрации (активности) ионов металла в растворе (при высокой концентрации ионов металла может происходить осаждение металла на пластинке и она зарядится положительно) и температуры. Для математического выражения этой зависимости В.Г. Нернстом в 1888г. было предложено следующее выражение:
Величина этого потенциала зависит от природы металла, концентрации (активности) ионов металла в растворе (при высокой концентрации ионов металла может происходить осаждение металла на пластинке и она зарядится положительно) и температуры. Для математического выражения этой зависимости В.Г. Нернстом в 1888г. было предложено следующее выражение:
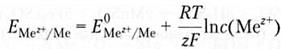
где E(Mez+/Me) — электродный потенциал; E0(Mez+/Me) — стандартный электродный потенциал (соответствует активности ионов металла 1 моль/л); R – универсальная газовая постоянная, Дж/моль-К; T — абсолютная температура; z — заряд иона металла; F — постоянная Фарадея (96 500 Кл/моль); C — молярная концентрация ионов.
После подстановки значений констант и перехода к десятичным логарифмам для температуры 298 К получим упрощенную форму уравнения Нернста:
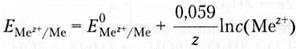
 2020-09-24
2020-09-24 79
79








