Электрохимическую цепь можно представить следующим образом:
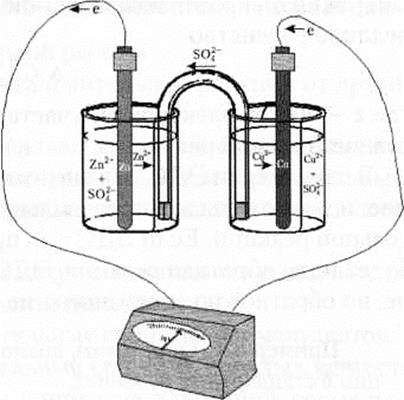
Рис. 7.2. Электрохимический гальванический элемент
(-)Zn | ZnSО4 || КСl || CuSO4| Cu (+)
В гальваническом элементе отрицательный заряд всегда имеет электрод с меньшим значением потенциала (анод), который пишется слева, электрод с большим значением потенциала (катод) указывается справа и имеет положительный заряд.
ЭДС (∆Е) электрохимического элемента можно рассчитать по формуле
∆Е = Е(Cu2+/Cu) – E(Zn2+/Zn)
В концентрационном элементе два электрода различаются между собой только концентрациями электролита в ячейках
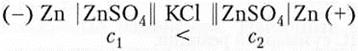
и его ЭДС рассчитывается по формуле
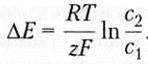
ЭДС любого гальванического элемента положительна, так как в нем идет самопроизвольный процесс, а, следовательно, изменение энергии Гиббса отрицательно.
 2020-09-24
2020-09-24 117
117








