В растворах комплексных соединений протекают следующие процессы.
1. Первичная диссоциация комплексов с внешней сферой на комплексный и внешнесферный ионы, которая протекает практически полностью по типу диссоциации сильных электролитов, например:
K3[Fe(CN)6] D 3К+ + [Fe(CN)6]3-
Диссоциации по такой схеме не подвергаются только нейтральные комплексные соединения без внешней сферы — неэлектролиты, например [Co(NH3)3(NO2)3], [PtCl2(NH3)2].
2. Вторичная диссоциация внутренней сферы комплексного иона на составляющие ее компоненты обратима и, подобно диссоциации многоосновных кислот, протекает ступенчато с последовательным отщеплением каждого лиганда. Однако обычно ее представляют в виде суммарного процесса:
[Fe(CN)6]3- D Fe3+ + 6CN-
Выражение константы этого равновесия (константы нестойкости) имеет следующий вид:
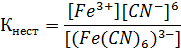
Величина, обратная константе нестойкости комплекса, называется константой устойчивости.
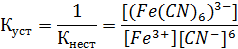
Константа Куст является термодинамической характеристикой устойчивости комплекса в растворе: чем более прочным является комплекс и чем больше энергии необходимо затратить для его разрушения, тем выше Куст.
Например, комплекс [Co(NH3)6]3+ более устойчив, чем комплекс [Cu(NH3)4]2+, и константы устойчивости у них равны 1,99∙1035 и 7,9∙1012 соответственно.
Зная величину константы нестойкости или устойчивости и исходную концентрацию координационного соединения в растворе, несложно рассчитать равновесные концентрации продуктов его диссоциации: свободного иона-комплексообразователя и лигандов.
В качестве примера определим концентрацию ионов Cu2+ в 0,010 М растворе нейтрального комплекса [Cu(gly)2]. Пусть в 1 литре раствора диссоциации подвергается х моль молекул [Cu(gly)2]
| [Cu(gly)2]0 | Сu2+ | gly- | |
| Сисх, моль/л | 0,010 | 0 | 0 |
| ∆С, моль/л | - х | + х | +2 х |
| Сравн, моль/л | 0,010 - х | х | 2 х |
Подставляя равновесные концентрации частиц Cu2+, gly и [Cu(gly)2] в выражение константы нестойкости, получаем
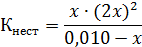
Значение Кнест комплекса [Cu(gly)2] равно 2,88∙10-16. Поскольку эта величина очень мала, то диссоциации подвергнется лишь незначительное количество [Cu(gly)2].
Поэтому 0,010 – х ≈ 0,010. Тогда х ≈ 9,0∙10-7 (моль/л).
Следовательно, степень диссоциации комплекса [Cu(gly)2] в его 0,010 М растворе составит 9,0∙10-7/0,010 = 9,0∙10-5 = 0,009%.
Помимо исходной концентрации координационного соединения, равновесная концентрация иона-комплексообразователя в растворе определяется многими факторами, в том числе температурой, pH и ионной силой раствора, а также присутствием избытка свободных ионов или молекул лиганда.
В соответствии с принципом Ле Шателье — Брауна увеличение концентрации лиганда приведет к смещению равновесия в сторону образования комплекса и к снижению концентрации свободного иона-комплексообразователя. Например, прибавление 0,010 моль глицината натрия к 1 л раствора [Cu(gly)2] из предыдущего примера приведет к возрастанию концентрации глицинат-ионов до 0,010 М и резкому изменению концентрации ионов Сu2+:
[Cu(gly)2] D Cu2+ + 2(gly)-
Таким образом, в присутствии даже относительно небольшого избытка лиганда равновесная концентрация иона-комплексообразователя уменьшается более чем в 107 раз.
При столь низких концентрациях свободные ионы-комплексообразователи не могут быть обнаружены какими-либо аналитическими методами и не обладают заметной биологической активностью, что широко используется в медицине при отравлениях тяжелыми металлами. Введение в организм значительных количеств малотоксичных лигандов (белков, полиаминов, ЭДТА и др.) способствует связыванию ионов тяжелых металлов в прочные комплексы и их последующему выведению из организма.
Лабораторная работа №8 Ф.И.О. ________________
группа __________________
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ.
Опыт №1. Получение соединений с комплексным анионом.
В пробирку внести 3-5 капель раствора нитрата ртути (II) и добавлять по каплям раствор йодида калия до полного растворения образовавшегося вначале осадка йодида ртути (II). Написать уравнения реакций:
а) получения нерастворимого йодида ртути (II);
________________________________________________________________
Написать схемы электролитической диссоциации полученного комплексного соединения, написать выражение для константы нестойкости комплекса.
________________________________________________________________
________________________________________________________________
________________________________________________________________
б) взаимодействия йодида ртути (II) с иодидом калия с получением комплексного соединения, в котором координационное число комплексообразователя равно 4.
________________________________________________________________
Написать схемы электролитической диссоциации полученного комплексного соединения, написать выражение для константы нестойкости комплекса.
________________________________________________________________
________________________________________________________________
________________________________________________________________
Опыт №2. Получение соединений с комплексным катионом.
В пробирку внесите 3-4 капли 0,5н раствора сульфата меди (II) и прибавьте каплями 2н раствор аммиака до выпадения осадка основной соли (CuОH)2SО4.
Отметьте цвет осадка. ___________________________________________________
Напишите соответствующие молекулярные и сокращенные ионные уравнения реакций.
________________________________________________________________
________________________________________________________________
________________________________________________________________
Потом прибавьте избыток 2н раствора аммиака до растворения осадка. Напишите соответствующие молекулярные и сокращенные ионные уравнения реакций.
________________________________________________________________
________________________________________________________________
________________________________________________________________
Напишите выражение общей константы нестойкости комплексного иона [Cu(NH3)4]2+.
________________________________________________________________
________________________________________________________________
Опыт №3. Обменные реакции в растворах комплексных соединений.
а) К 2-3 капелям 0,5н раствора сульфата меди (II) прибавьте столько же капель 1н раствора гексацианоферата (II) калия K4[Fe(CN)6]. Отметьте цвет образованного осадка и напишите уравнение реакции.
________________________________________________________________
________________________________________________________________
б) К 2-3 капелям 1н раствора хлорида железа (III) прибавьте столько же 1н раствора гексацианоферата (II) калия K4[Fe(CN)6]. Отметьте, что происходит. Напишите уравнение реакции.
________________________________________________________________
________________________________________________________________
в) К 2-3 капелям 1н раствора сульфата железа (II) прибавьте такой же объем 1н раствора гексацианоферата (III) калия K3[Fe(CN)6]. Отметьте, что происходит. Напишите уравнение реакции.
________________________________________________________________
________________________________________________________________
Опыт №4. Сравнение устойчивости тиоцианатного, фторидного и цианидного комплексов железа (III).
а) К раствору соли железа (III) прилейте несколько капель раствора тиоцианата калия или аммония. К полученному раствору добавьте фторид натрия. Составьте уравнения реакций.
________________________________________________________________
б) К раствору гексацианоферрата (III) калия добавьте раствор тиоцианата калия или аммония. Объясните, почему окраска раствора не изменяется.
________________________________________________________________
________________________________________________________________
Опыт №5. Получение циклического или хелатного комплексного соединения.
В две пробирки внесите по 3-4 капли 1н раствора хлорида кальция и по 2-3 капли аммиачного буферного раствора (NH4OH + NH4Cl). В одну из пробирок прибавьте 2-3 капли 1н раствора трилона Б. Потом в обе пробирки прибавьте по 2-3 капли 1н раствора оксалата аммония.
Отметьте, что происходит в каждой пробирке. Объясните, почему в пробирке, где находится трилон Б, не получается осадок. Напишите соответствующие уравнения реакций.
________________________________________________________________
________________________________________________________________
________________________________________________________________
________________________________________________________________
________________________________________________________________
Опыт №6. Получение двойного комплексного соединения.
Двойными называются комплексные соединения, в которых комплексами являются и катион, и анион.
Для получения одного из таких соединений в пробирку внести 3-5 капель раствора желтой кровяной соли – раствора гексацианоферрата (II) калия K4[Fe(CN)6] и 5-6 капель раствора сульфата никеля (II). К полученному осадку гексацианоферрата (II) никеля (II) Ni2[Fe(CN)6] добавить 25%-й раствор аммиака до полного растворения осадка. Одновременно наблюдать образование бледно-лиловых кристаллов комплексной соли [Ni(NH3)6]2[Fe(CN)6].
В описании опыта привести уравнения реакций образования гексацианоферрата(II) никеля (II) и взаимодействие его с аммиаком и название полученной комплексной соли. Определить заряды комплексных ионов и комплексообразователя.
________________________________________________________________
________________________________________________________________
________________________________________________________________
________________________________________________________________
________________________________________________________________
Опыт №7. Окислительно-восстановительная реакция с участием комплексного соединения.
К 4-5 каплям раствора перманганата калия добавить для создания кислой среды 5-6 капель серной кислоты, а затем прибавлять по каплям раствор желтой кровяной соли K4[Fe(CN)6], обладающей восстановительными свойствами. Наблюдать обесцвечивание раствора.
Написать уравнение окислительно-восстановительной реакции, в которой марганец (+7) в составе перманганата калия восстанавливается до марганца (+2), а железо (+2) в составе комплексного соединения окисляется до железа (+3) с образованием нового (какого?) комплексного соединения.
________________________________________________________________
________________________________________________________________
________________________________________________________________
Опыт №8. Исследование прочности комплексных ионов.
В двух пробирках получить осадки хлорида серебра путем взаимодействия растворов нитрата серебра и хлорида натрия (калия). В одну пробирку добавить 25%-й раствор аммиака, а в другую – раствор тиосульфата натрия Na2S2О3 до растворения осадков. Растворение осадков свидетельствует об образовании комплексных соединений.
В обе пробирки добавить по 2 капли раствора KI и слегка встряхнуть их. Выпадение осадка AgI в одной из пробирок (какой?) указывает на непрочность комплексного иона в полученном комплексном соединении.
В отчёте написать:
1) уравнения реакций хлорида серебра с аммиаком и тиосульфатом натрия (образуются комплексные соединения с координационным числом, равным двум);
________________________________________________________________
________________________________________________________________
________________________________________________________________
2) названия комплексных соединений;
________________________________________________________________
________________________________________________________________
3) схемы электролитической диссоциации комплексных соединений и выражения для констант нестойкости комплексных ионов.
________________________________________________________________
________________________________________________________________
________________________________________________________________
________________________________________________________________
________________________________________________________________
________________________________________________________________
Для какого комплексного иона константа нестойкости больше, какой комплексный ион прочнее? На присутствие каких ионов в растворе комплексной соли указывает появление осадка йодида серебра?
________________________________________________________________
________________________________________________________________
________________________________________________________________
"Зачислено" _____ баллов
"____"_________________20___г. __________________
(подпись преподавателя)
Тема 9.
 2020-09-24
2020-09-24 184
184








