Взвешивание
Ознакомиться с весами, имеющимися в лаборатории, усвоить порядок работы на них, провести контрольное взвешивание образцов.
Измельчение.
Ознакомиться с оборудованием, применяемым для измельчения твердых материалов (ступка, пестик).
Растворение.
Ознакомиться с химической посудой, предназначенной для приготовления приблизительных и точных растворов.
Нагревание.
Ознакомиться с процессами нагревания и выпаривания, с применяемой для этих целей химической посудой.
Фильтрование.
Ознакомиться с фильтрованием без вакуума и под вакуумом. Изготовить простой (рис. 9) и складчатый фильтры для фильтрования, отфильтровать суспензию от осадка.
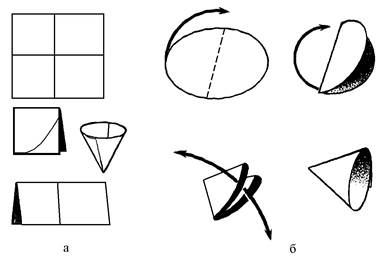
Рис. 9. Приготовление фильтра из фильтровальной бумаги (а) и из готового фильтра (б)
Высушивание.
Ознакомиться с высушиванием путем испарения воды при нагревании (выпаривании). Ознакомиться с посудой (выпарительная чашка, тигельные щипцы) (рис. 2), при помощи которой проводится выпаривание.
ОПЫТ № 2. Очистка загрязненной поваренной соли.
Взвесить на электронных весах 10 г загрязненной поваренной соли, перенести в фарфоровую ступку и тщательно измельчить с помощью пестика. После пересыпать смесь веществ в химический стакан и растворить в 20 мл воды. Необходимое количество воды отмерять мерным цилиндром. Содержимое стакана перемешать стеклянной палочкой до полного растворения соли.
Очистку полученного раствора от песка проводить при помощи фильтрования без вакуума. Для этого необходимо приготовить фильтр следующим образом: листок фильтровальной бумаги шириной в 2 раза больше диаметра воронки дважды сложить пополам, примерить к воронке и отрезать по дуге, так чтобы край бумаги был на 0,5 см ниже края воронки. Раскрытый фильтр поместить в воронку и смочить водой. Аккуратно перенести мутный раствор на фильтр по стеклянной палочке так, чтобы палочка не повредила фильтр.
Отфильтрованный раствор соли (фильтрат) вылить в фарфоровую чашку для выпаривания и нагреть на нагревательном приборе (спиртовка или электроплитка). Процесс выпаривания проводить до образования густой кашицы соли, периодически помешивая фильтрат стеклянной палочкой. Снять фарфоровую чашку тигельными щипцами на асбестовую сетку.
Вопросы к Защите
1. Дать точные характеристики всех методов, необходимых для работы в химических лабораториях.
2. Из предложенного преподавателем списка химического оборудования соотнести приборы и посуду к методам, в которых они используются.
3. Правила приготовления фильтра. Какие фильтры вы знаете?
Лабораторная работа № 2
МЕТОДЫ ОЧИСТКИ ВЕЩЕСТВ
Теоретическая часть
В лабораторной практике применяются различные методы очистки веществ: перекристаллизация, возгонка, перегонка, поглощение. Для очистки твердых веществ применяется перекристаллизация и возгонка, для очистки жидкостей – фильтрование и перегонка, для очистки газов – поглощение газов-примесей различными веществами.
Перекристаллизация
Перекристаллизация основывается на различной растворимости вещества и содержащихся в нем примесей при различных температурах. Если, например, приготовить насыщенный при 45ºС раствор нитрата калия на 100 г воды, содержащий примесь медного купороса, а затем охладить его до 0ºС, выпадет в осадок 60 г нитрата калия. Медный купорос не достигнет насыщения (т. к. его очень мало) при указанном понижении температуры, а потому и не выпадает в осадок. Некоторые количества соли-примеси могут увлекаться кристаллами осадка, поэтому чтобы получить полностью чистое вещество нужно проводить повторные перекристаллизации. Чем меньше по размеру выделившиеся кристаллы (при быстром охлаждении выделяются мелкие кристаллы, при медленном – крупные), тем более чистыми они получаются, так как в этом случае они меньше захватывают маточного раствора, содержащего примеси других веществ. Маточным раствором называют насыщенный раствор соли, который остается после фильтрования выпавших кристаллов. Дальнейшее уменьшение содержание примесей достигается промыванием кристаллов растворителем после отделения их от маточного раствора.
Возгонка
Возгонкой, или сублимацией, называется превращение твердого вещества в пар без образования жидкости.
При достижении температуры возгонки, твердое вещество без плавления переходит в пар, который конденсируется в кристаллы на поверхности охлажденных предметов.
Возгонка всегда происходит при температуре ниже температуры плавления вещества. Используя свойство ряда веществ (йода, нафталина, бензойной кислоты, нашатыря и др.) возгоняться, легко получить их в чистом виде, если смесь не возгоняется (рис. 10).
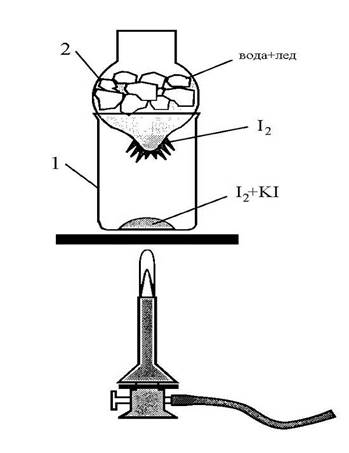
| Рис. 10. Прибор для сублимации йода: 1 – стакан; 2 – колба |
Перегонка
Перегонка, или дистилляция основана на способности жидкости при кипении переходить в пар, в то время как растворенные в ней твердые вещества в пар не переходят. Образовавшийся пар при охлаждение конденсируется, образуя жидкость, которая не содержит примеси. Например, с помощью перегонки очищают воду от солей, которые в ней содержатся, так получается дистиллированная вода. Для перегонки небольших количеств жидкости в лабораторных условиях применяют прибор для перегонки. С помощью прибора для перегонки можно разделять смеси жидкостей и получать их в чистом виде.
Очистка газов
Очистка газов от примесей достигается путем пропускания их через такие вещества, которые поглощают эти примеси. Например, при получении в аппарате Киппа двуокиси углерода вместе с ней выходят примеси – хлороводород и пары воды. Чтобы очистить полученный газ его нужно пропустить сначала через промывные склянки с водой (для поглощения хлороводорода) и с серной концентрированной кислотой (для поглощения паров воды).
Для определения степени чистоты веществ применяют различные физические и химические методы исследования.
К физическим методам относят методы, основанные на определении удельного веса вещества, температуры кипения и плавления, показателя преломления и многие другие.
К химическим методам относят качественные и количественные анализы на содержание примесей.
Абсолютно чистых веществ нет. Применяемые в лабораториях вещества имеют различную степень чистоты. Максимально допустимые количества примесей в веществах устанавливается общественным стандартом и в зависимости от чистоты реактива накладывают на него определенную маркировку, например, ч. (чистое), х.ч. (химически чистое), ч.д.а. (чистое для анализа).
ВОПРОСЫ К ДОПУСКУ
1. Опишите порядок выполнения следующих опытов:
а) очистка медного купороса перекристаллизацией;
б) очистка йода возгонкой и плавление йода;
в) очистка воды перегонкой;
г) очистка углекислого газа.
2. Чтобы получить более чистые кристаллы, каким образом нужно охлаждать раствор – быстро или медленно?
3. В каких случаях применяется фильтрование под вакуумом (давлением), в каких – без вакуума?
4. Для чего необходимо непрерывное перемешивание раствора при кристаллизации?
5. Сколько граммов CuSO4·10H2O и воды необходимо взять для приготовления 15 г раствора, содержащего 34,9 % CuSO4?
6. Сколько граммов CuSO4·10H2O выпадет в осадок при охлаждении 15 г раствора, содержащего 34,9 % CuSO4 до 20ºС? Если при 20ºС насыщенный раствор сульфата меди содержит 17,2 % CuSO4.
Экспериментальная часть
 2020-09-24
2020-09-24 247
247








