Л. Н. Бугерко
С.В. Бин
Э. П. Суровой
Лабораторный практикум по химии
Учебное пособие
Кемерово 2012
ББК Г1я73-5
УДК 546(075)
Б 90
Печатается по решению редакционно-издательского совета ФГБОУ ВПО «Кемеровский государственный университет»
Рецензенты:
доктор техн. наук, профессор В. В. Козик
(Национальный исследовательский Томский государственный университет)
академик РАЕН, доктор хим. наук, профессор Т. Г. Черкасова (ФГБОУ ВПО «Кузбасский государственный технический университет им. Т.Ф. Горбачева»)
Бугерко, Л. Н.
Б 90 Лабораторный практикум по химии: учеб. пособие / Л. Н. Бугерко, С.В. Бин, Э. П. Суровой;ФГБОУ ВПО «Кемеровский государственный университет». – Кемерово, 2012.
–136 с.
ISBN
Настоящее пособие составлено в соответствии с ФГОС ВПО 3-го поколения для студентов I курса, обучающихся на химическом и биологическом факультетах. Пособие является частью учебно-методического комплекса по дисциплинам «Неорганическая химия» и «Химия», и преследует цель помочь студентам в самостоятельной работе при изучении дисциплины, выполнении индивидуальных заданий, контрольной работы и подготовке к экзамену.
| ISBN | © © | ББК Г1я73-5 Бугерко Л. Н., Бин С.В., Суровой Э. П., 2012 Кемеровский государственный университет, 2012 |
Содержание
| стр. | |
| Введение…………………………………………………........................ | 4 |
| Рекомендации по проведению и оформлению лабораторных работ……………………………………………………........................... | 4 |
| Техника безопасности………………………………………………….. | 5 |
| Основные классы неорганических соединений………….…………… | 7 |
| Лабораторная работа № 1…………………………………................. Техника лабораторных работ | 18 |
| Лабораторная работа № 2…………………………………................. Методы очистки веществ | 27 |
| Лабораторная работа № 3…………………………………................. Определение молярной массы газа | 33 |
| Лабораторная работа № 4…………………………………................. Тепловые эффекты химических реакций. Энтальпия. Закон Гесса | 39 |
| Лабораторная работа № 5…………………………………................. Приготовление растворов заданной концентрации | 44 |
| Лабораторная работа № 6…………………………………................. Окислительно –восстановительные реакции | 54 |
| Лабораторная работа № 7…………………………………................. Реакции в растворах электролитов и неэлектролитов | 62 |
| Лабораторная работа № 8…………………………………................. Ионное произведение воды. Водородный показатель. Гидролиз | 72 |
| Лабораторная работа № 9…………………………………................. Скорость химических реакций. Химическое равновесие. Катализ | 81 |
| Лабораторная работа № 10…………………………………............... Металлы | 94 |
| Лабораторная работа № 11………………………………................... Неметаллы | 98 |
| Лабораторная работа № 12………………………………................... Свойства солей, кислот и оснований | 107 |
| Лабораторная работа № 13………………………………................... Решение экспериментальных задач по теме | 109 |
| Лабораторная работа № 14………………………………................... Комплексные соединения | 111 |
| Лабораторная работа № 15………………………………................... Коллоидные растворы. Получение золя гидроксида железа (III) | 116 |
| Список рекомендуемой литературы……………..……………………. | 120 |
| Приложение…..……………………………………………..................... | 121 |
Введение
Лабораторные работы для многих вузовских специальностей стали одной из важнейших форм самостоятельной работы студентов в учебное время, стимулирующие познавательный интерес студентов, развивая как интеллектуальные умения и навыки, так и практические.
Учебно-методическое пособие по дисциплине «Химия» для студентов биологического факультета по специальности «География» содержит краткую теоретическую часть, описание лабораторных работ, вопросы для допуска и защиты работы.
Пособие составлено таким образом, чтобы каждый студент самостоятельно подготовился к выполнению лабораторных работ по химии: умел изложить ход работы, составлять уравнения реакций, объяснить результаты выполненных опытов и сформулировать выводы из них.
Допуск к экзамену студент получает по предъявлению лабораторного журнала с пометкой преподавателя о выполнении всех работ, предусмотренных планом практикума.
Рекомендации по проведению и оформлению лабораторных работ
Перед занятием (домашняя самоподготовка) студенты должны проработать вопросы допуска к лабораторной работе и частично оформить отчет (все, кроме описания наблюдений и выводов).
Отчет оформлять следующим образом:
Дата:_____________________________________________________
Тема:_____________________________________________________
Цель:_____________________________________________________
Оборудование:_____________________________________________
Реактивы:_________________________________________________
Ход работы:_______________________________________________
Номер опыта:______________________________________________
Название опыта:____________________________________________
Краткое описание проведения опыта:__________________________
Уравнения реакций:_________________________________________
Подробное описание наблюдений:____________________________
Вывод по опыту: ___________________________________________
Вывод (общий по всей работе):_______________________________
В начале каждого занятия преподаватель проводит допуск в форме опроса или в форме беседы, с целью проверить уровень подготовки студентов к занятию, разобрать методику проведения отдельных опытов.
В ходе выполнения практической работы преподаватель следит за соблюдением правил техники безопасности, следит за правильностью выполнения опытов, если необходимо помогает студентам объяснить наблюдения, выявить допущенные ошибки, в результате которых опыт не получился, сформулировать выводы, оформить отчет.
После выполнения лабораторной работы преподаватель проверяет отчет и проводит со студентами защиту практической работы, чтобы проконтролировать уровень усвоения теоретического материала, глубину сущности наблюдаемых явлений, умения наблюдать, описывать, объяснять, анализировать, делать выводы, применять знания на практике. Защита работы проводится индивидуально (устно или письменно), отвечая на контрольные вопросы.
ТЕХНИКА БЕЗОПАСНОСТИ
1. К выполнению работ допускаются студенты, прошедшие в начале полугодия инструктаж по общим требованиям, описанным в инструкциях по технике безопасности и охраны труда.
2. Выполнение работ проводится только при наличии халата и после допуска, при котором наряду с общими вопросами уточняются вопросы по технике безопасности.
3. Запрещается работа в лаборатории на неисправном оборудовании, с неисправными приборами и посудой.
4. Во избежание отравления запрещается хранить пищу в химических лабораториях.
5. Работу, связанную с применением ядовитых, взрывоопасных веществ необходимо проводить в вытяжном шкафу. Створки вытяжных шкафов должны быть закрыты. При необходимости створки можно поднимать, но не более, чем на 20–30 см так, чтобы между лицом работающего и объектом находилось стекло створки.
6. Агрессивные химические реактивы: концентрированные кислоты, щелочи, сильнодействующие реактивы, летучие ядовитые вещества необходимо хранить под тягой в толстостенной посуде.
7. Работу с концентрированными растворами кислот, щелочей необходимо проводить в резиновых перчатках и защитных очках.
8. При проливе концентрированных кислот, щелочей, едких жидкостей необходимо пролитый продукт засыпать песком, песок удалить и место, где была пролита жидкость, хорошо промыть водой.
9. Для нагревания необходимо использовать тонкостенную химическую посуду с отметкой, характеризующей термостойкость стекла.
10. Первая доврачебная помощь:
а) при ранении стеклом нужно удалить его остатки из раны, смазать руку йодом, наложить стерильную повязку, при артериальном кровотечении – жгут или закрутку, обратиться к врачу;
б) при термических ожогах первой степени обожженное место смазывают вазелином. При ожогах второй степени (появление пузырей) делают примочки из перманганата калия (5 %) или этилового спирта. При более тяжелых ожогах необходимо отправить пострадавшего к врачу;
в) при ожогах концентрированными кислотами или щелочами необходимо обожженное место промыть сильной струей воды, затем наложить примочку: при ожогах кислотой – из 2 % раствора соды, при ожогах щелочью – 2 % раствора борной (уксусной) кислоты.
Основные классы неорганических соединений
В зависимости от состава и свойств вещества можно классифицировать следующим образом:
ВЕЩЕСТВА
Простые Сложные – органические
Металлы Неметаллы Неорганические
Гидриды Пероксиды Оксиды Гидраты
Надпероксиды оксидов
Озониды кислотные кислотные
основные основные
амфотерные амфотерные
Комплексные Галогенангидриды Соли
соединения средние
кислые
основные
Название химических соединений, составление эмпирических и графических формул связано с использованием понятия степени окисления.
Степень окисления – условный заряд атома в соединении, если ковалентную полярную связь условно принять за ионную. Для s, p-элементов главных подгрупп периодической системы характерны следующие положительные степени окисления – таблица 1.
Для элементов I и II групп характерны положительные степени окисления, равные номеру группы; для элементов III–VI групп характерны две степени окисления: одна из них равна номеру группы, другая – (номер группы – 2). Исключения: для алюминия неустойчива степень окисления +1, для кремния – +2. Для азота известны следующие степени окисления: –3, –2, –1, +1, +2, +3, +4, +5; для кислорода – –2, –1, +2; для фтора – только одна –1.
| Таблица 1 | |||||||
| Степени окисления s, p-элементов главных подгрупп | |||||||
| номер группы | I | II | III | IV | V | VI | VII |
| степень окисления | +1 | +2 | +1 +3 | +2 +4 | +3 +5 | +4 +6 | +1 до +7 |
Для элементов побочных подгрупп положительные степени окисления могут принимать значения от +1 до +8. Необходимо запомнить более устойчивые для следующих элементов:
Ag+1; Cu+1 Cu+2; Au+1 Au+3;
Zn+2; Hg+1 Hg+2;
Cr+3 Cr+6;
Mn+2 Mn+4 Mn+6 Mn+7;
Fe+2 Fe+3; Co+2 Co+3;
f – элементы обычно проявляют степень окисления равную +3.
ОКСИДЫ
Оксиды – соединения элементов с кислородом, в которых кислород является более электроотрицательным элементом.
Согласно правилам международной номенклатуры, название оксидов составляется таким образом: в именительном падеже называется слово «оксид», за ним следует название элемента в родительном падеже с указанием степени окисления (если для элемента характерны несколько степеней окисления).
СаО – оксид кальция,
FeO – оксид железа (II).
Учитывая, что атом кислорода двухвалентен (степень окисления –2) и каждая валентность условно изображается черточкой, составляются графические формулы оксидов.
Например:
| Cl2O7 CO2 | 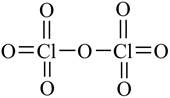

|
Отметим, что реальное строение веществ отражается графическими формулами в случае оксидов с ковалентными связями, состоящими из отдельных молекул. Поэтому для оксида с ионной связью, например СаО, полимерных оксидов, например, SiO2, графические формулы условны.
По химическим свойствам оксиды делят на основные, кислотные и амфотерные.
Свойства оксидов различных элементов можно предсказать на основании положения элемента в периодической системе.
s, p – элементы главных подгрупп, расположенные в периодической системе слева внизу, образуют основные оксиды; справа вверху – кислотные. Элементы, расположенные в периодической системе по диагонали – Be, Al, Ge, Sn, Pb, образуют амфотерные оксиды (в любой степени окисления). Исключение составляют оксиды Ga2O3, In2O3, Tl2O3, As2O3, Sb2O3, которые являются амфотерными и Bi2O3 – основной оксид. Оксиды элементов побочных подгрупп ZnO, Cr2O3, MnO2, Fe2O3 обладают амфотерными свойствами. При повышении степени окисления элемента усиливаются кислотные свойства оксидов.
MnO – основной оксид,
MnO2 – амфотерный оксид,
(MnO3), Mn2O7 – кислотные оксиды.
Основные оксиды –оксиды, которым соответствуют основания (оксиды металлов со степенью окисления +1, +2, реже +3).
Например, Na2O, CaO, MgO.
Кислотные оксиды –оксиды, которым соответствуют кислоты (оксиды неметаллов и переходных металлов в высоких степенях окисления).
Например, SO2, CO2, CrO3, Mn2O7.
Амфотерные оксиды – оксиды, проявляющие как основные, так и кислотные свойства
ZnO + 2HCl = ZnCl2 + H2O,
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
или в упрощенном виде:
ZnO + 2NaOH = Na2ZnO2 + H2O.
ГИДРАТЫ ОКСИДОВ
Основные гидроксиды (основания) – соединения, при диссоциации которых в качестве отрицательно заряженных анионов образуются ОН-.
Название основания дается следующим образом: в именительном падеже называется слово «гидроксид», затем в родительном падеже идет название элемента (если элемент имеет переменную степень окисления, то она указывается римскими цифрами после элемента).
NaOH – гидроксид натрия,
Cr(OH)3 – гидроксид хрома (III).
Количество ОН–групп определяет кислотность основания (LiOH – однокислотное, Mg(OH)2 – двухкислотное).
Графические формулы гидроксидов строятся исходя из того, что гидроксид–ион одновалентен.

| 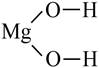
| 
|
При написании графических формул оснований (так же как и оксидов) необходимо учитывать условность графической формулы. Во многих случаях графическая формула не отражает строения данного вещества, вещество в твердом виде может иметь ионную структуру. (Это замечание справедливо и для солей).
Кислотные гидроксиды (кислоты) – соединения, при диссоциации которых образуется ион Н+.
Название бескислородных кислот дается следующим образом: к элементу, образующему кислоту, добавляется термин «оводородная» или «истоводородная» кислота:
H2S – сероводородная кислота,
HF – фтористоводородная кислота.
Названия кислородсодержащих кислот строятся из двух слов – прилагательного, характеризующего кислотообразующий элемент (с учетом его степени окисления), и существительного «кислота». Если кислотообразующий элемент находится в низшей степени окисления, то к корню названия элемента добавляется –новатистая, в средней степени окисления: – истая, –нистая, –новатая, в высшей степени окисления: –ная, –овая, –евая:
HClO – хлорноватистая кислота,
HClO2 – хлористая кислота,
HCIO3 – хлорноватая кислота,
HClO4 – хлорная кислота.
Если кислотообразующий элемент в одной и той же степени окисления образует несколько кислот, отличающихся между собой содержанием кислорода и водорода (по содержанию воды), то перед названием элемента добавляют префиксы: мета – если кислота содержит меньшее количество атомов водорода и кислорода, мезо – среднее количество, орто – максимальное количество:
H2TeO4 – метателлуровая кислота,
H4TeO5 – мезотеллуровая кислота,
H6TeO6 – ортотеллуровая кислота.
Некоторые кислотообразующие элементы при одной и той же степени окисления образуют несколько кислот, отличающихся между собой числом атомов кислотообразующего элемента (изополикислоты). Называют последние, добавляя к основному названию кислоты числительное, указывающее число атомов элемента кислотообразователя:
H2S2O7 – дисерная (пиросерная) кислота,
H2P2O7 – дифосфорная (пирофосфорная) кислота.
По числу атомов водорода кислоты делятся на одноосновные (HCl, HNO3) и многоосновные (H2SO4 – двухосновная, H3PO4 – трехосновная кислота).
При составлении графических формул кислот необходимо учитывать:
1) в молекулах бескислородных кислот атомы водорода связаны с атомами кислотообразователя:
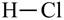
| 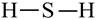
|
2) в молекулах кислородосодержащих кислот атомы водорода связаны с атомами кислотообразователя через кислород:

|
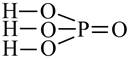
|
Амфотерные гидроксиды –гидроксиды, способные проявлять как кислотные, так и основные свойства:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O,
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4].
Названия амфотерных гидроксидов строятся как по типу основания, так и по типу кислоты:
Cr(OH)3 – гидроксид хрома (III),
H3CrO3 – ортохромистая кислота.
Ниже приведены названия некоторых кислот и соответствующих им ионов (таблица 2).
| Таблица 2 | ||
| Кислота | Название кислоты | Название иона |
| HАlO2 H3AlO3 HAsO2 H3AsO3 HAsO3 H3AsO4 H2BeO2 HBO2 H3BO3 HClO HClO2 HClO3 HClO4 HCrO2 H3CrO3 H2CrO4 H2Cr2O7 HNO2 HNO3 H3PO3 HPO3 H3PO4 H4P2O7 H2SO3 H2SO4 H2S2O7 HSbO2 H3SbO3 HSbO3 H3SbO4 H2SiO3 H4SiO4 H2PbO2 H2PbO3 H4PbO4 H2ZnO2 | Метаалюминиевая Ортоалюминиевая Метамышьяковистая Ортомышьяковистая Метамышьяковая Ортомышьяковая Бериллиевая Метаборная Ортоборная Хлорноватистая Хлористая Хлорноватая Хлорная Метахромистая Ортохромистая Хромовая Дихромовая Азотистая Азотная Ортофосфористая Метафосфорная Ортофосфорная Дифосфорная Сернистая Серная Дисерная Метасурьмянистая Ортосурьмянистая Метасурьмяная Ортосурьмяная Метакремниевая Ортокремниевая Свинцовистая Метасвинцовая Ортосвинцовая Цинковая | Метаалюминат Ортоалюминат Метаарсенит Ортоарсенит Метаарсенат Ортоарсенат Бериллат Метаборат Ортоборат Гипохлорит Хлорит Хлорат Перхлорат Метахромит Ортохромит Хромат Дихромат Нитрит Нитрат Ортофосфит Метафосфат Ортофосфат Дифосфат Сульфит Сульфат Дисульфат Метаантимонит Ортоантимонит Метаантимонат Ортоантимонат Метасиликат Ортосиликат Плюмбит Метаплюмбат Ортоплюмбат Цинкат |
СОЛИ
Средние соли (нормальные) –продукт полного замещения ионов водорода кислоты на ионы металла, или гидроксид–ионов основания на кислотный остаток
Cu(OH)2 + H2SO4 = CuSO4 + H2O.
Название средней соли дается следующим образом: для солей бескислородных кислот – к латинскому названию неметалла добавляется суффикс –ид. Если металл имеет переменную степень окисления, после названия металла указывается его степень окисления:
KCl – хлорид калия,
FeCl2 – хлорид железа (II).
Называя соли кислородсодержащих кислот, руководствуются следующими принципами:
1) при постоянной степени окисления центрального атома название соли оканчивается слогом –ат:
Na2CO3 – карбонат натрия;
2) при переменной степени окисления –ат или приставка пер– (высшая степень окисления центрального атома); –ит или приставка гипо– (низшая степень окисления центрального атома):
BaSO4 – сульфат бария,
Na2SO3 – сульфит натрия,
NaClO – гипохлорит натрия,
KClO4 – перхлорат калия;
3) если кислота имеет несколько форм, то ее соли имеют соответствующие названия:
Na3PO4 – ортофосфат натрия,
KPO3 – метафосфат калия;
4) если металл имеет переменную степень окисления, ее указывают после названия металла в скобках, римскими цифрами:
FeSO4 – сульфат железа (II).
При изображении графических формул солей (средних, кислых, основных) необходимо исходить из графических формул оснований и кислот.
Изобразим графическую формулу ортофосфата кальция Ca3(PO4)2:
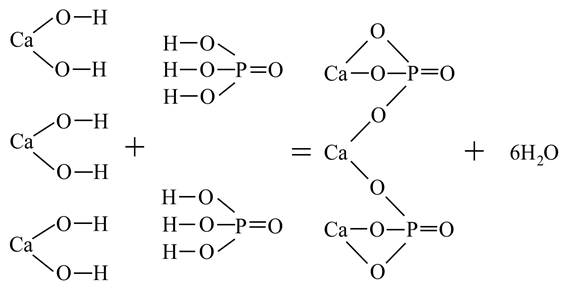
Кислые соли –продукт неполного замещения ионов водорода кислоты на ионы металла.
Кислые соли образуют многоосновные кислоты (при избытке кислоты):
Cu(OH)2 + 2H2SO4 = Cu(HSO4)2 + 2H2O.
Названия кислых солей строятся аналогично названиям нормальных солей, но в названия анионов кислот добавляется приставка гидро–:
NaHS – гидросульфид натрия,
NaH2PO4 – дигидроортофосфат натрия.
Графическая формула Ca(HCO3)2:

Основные соли –продукт неполного замещения гидроксид–ионов основания анионами кислот.
Основные соли образуют многокислотные основания (при избытке основания):
2Cu(OH)2 + H2SO4 = (CuOH)2SO4 + 2H2O.
В названии основных солей (так же как средних и кислых) указывается сначала анион, затем катион, к названию катиона добавляется приставка гидроксо–:
ZnOHCl – хлорид гидроксоцинка,
(FeOH)2SO4 – сульфат гидроксожелеза (II),
(Fe(OH)2)3PO4 – ортофосфат дигидроксожелеза (III).
Графическая формула (MgOH)2SO4:

Кислые соли (наряду с общими свойствами солей) обладают свойствами кислот:
Cu(HSO4)2 + Cu(OH)2 = 2CuSO4 + 2H2O.
Основные соли обладают свойствами оснований:
(CuOH)2SO4 + H2SO4 = 2CuSO4 + 2H2O.
С другой стороны, из средних солей могут быть получены как кислые, так и основные соли:
Na3PO4 + 2H3PO4 = 3NaH2PO4
FeSO4 + Fe(OH)2 = (FeOH)2SO4.
Контрольные задания
1. Изобразите графические формулы и назовите оксиды: K2O, Tl2O, MgO, CO, B2O3, ClO2, N2O5, Mn2O7.
2. Изобразите графические формулы и назовите следующие гидроксиды: LiOH, Cu(OH)2, Ca(OH)2, Al(OH)3, Fe(OH)3, Sn(OH)4.
3. Изобразите графические формулы и назовите следующие кислоты: HClO, HBrO2, HIO3, H2TеO3, H6TеO6, H2S2O3, H2MnO4, HNO2, H3AsO3, H2SiO3, H2S2O7.
4. Напишите эмпирические и графические формулы кислот следующих элементов: йода, марганца, теллура.
5. Изобразите графические формулы и назовите следующие соли: NaAlO2, K3AlO3, Li3AsO3, Pb3(AsO4)2, KBrO, Ca(ClO)2, Cu(ClO3)2, FeCr2O7, Fe(NO3)3, Na2TeO4, KMnO4, CaSiO3, Li4PbO4, CuZnO2.
6. Напишите эмпирические формулы следующих солей: а) карбоната лития, б) сульфата магния, в) метасиликата железа (III), г) дихромата аммония, д) нитрита серебра, е) бромида алюминия, ж) метафосфата кальция, з) ортоплюмбата меди (I), и) хромата калия, к) ортоарсенита кобальта (II).
7. Напишите эмпирические и графические формулы следующих солей: а) метафосфата дигидроксоалюминия, б) сульфата дигидроксожелеза (III), в) хромата гидроксомагния, г) карбоната гидроксоцинка, д) нитрата дигидроксохрома (III), е) хлорида гидроксожелеза (III).
Таблица 3 | |||||||||
| Классификация оксидов p-элементов по периодической системе | |||||||||
| № | III | IV | V | VI | VII | ||||
| +3 | +2 +4 | +3 +5 | +4 +6 | +1 +3 +5 +7 | |||||
| 2 | B2O3 | HBO2 H3BO3 | COб/р CO2 | H2CO3 | N2O3 N2O5 | HNO2 HNO3 | O2 | OF2 | |
| 3 | Al2O3 | HAlO2 H3AlO3 ↓Al(OH)3 | SiO2 | (H2SiO3)n ↓SiO2·H2O | P2O3 P2O5 | H3PO3 H3PO4 | SO2 SO3 | H2SO3 H2SO4 | Cl2O HClO Cl2O3 HClO2 Cl2O5 HClO3 Cl2O7 HClO4 |
| 4 | Ga2O3 | H3GaO3 ↓Ga(OH)3 | GeO GeO2 | ↓Ge(OH)2 ↓GeO2·H2O | As2O3 As2O5 | H3AsO3 H3AsO4 | SeO2 SeO3 | H2SeO3 H2SeO4 | Br2O5 HbrO3 Br2O7 HBrO4 |
| 5 | In2O3 | In(OH)3 ↓H3InO3 | SnO SnO2 | ↓Sn(OH)2 (H2SnO3)n α, β | Sb2O3 Sb2O5 | Sb(OH)3 H3SbO4 | TeO2 TeO3 | H2TeO3 H2TeO4 2H2O | I2O5 HIO3 I2O7 H5IO6 |
| 6 | Tl2O3→Tl2O+O2 Tl2O→TlOH | PbO PbO2 | ↓Pb(OH)2 PbO2·H2O | Bi2O3 | Bi(OH)3 | Po | At | ||
 2020-09-24
2020-09-24 207
207







