CH3COONa ® CH3COO– + Na+ (a = 1)

 CH3COOH CH3COO– + Н+ (a<<1, поскольку диссоциация подавлена присутствием одноименных ацетатных ионов, образующихся при диссоциации соли).
CH3COOH CH3COO– + Н+ (a<<1, поскольку диссоциация подавлена присутствием одноименных ацетатных ионов, образующихся при диссоциации соли).
При добавлении к такому буферному раствору какой-либо кислоты (а значит, на самом деле, Н+), протоны связываются с ацетат-ионами соли:
CH3COO– + Н+ ® CH3COOH
В результате концентрация Н+ сохраняется постоянной, а, следовательно, не изменяется и pH раствора. Т.о. буферная емкость по отношению к кислоте определяется количеством ацетата натрия в растворе.
При добавлении к раствору основания (OH–-ионов), происходит взаимодействие этих ионов с протонами, образующимися при диссоциации кислоты:
Н+ + OH– ® H2O
В результате равновесие диссоциации смещается вправо (по принципу Ле Шателье), в растворе опять образуются протоны, и рН не изменяется. Т.о. буферная емкость по отношению к основанию определяется количеством уксусной кислоты в растворе.
Механизм действия основного буферного раствора аналогичен.
РН буферного раствора

 CH3COONa ® CH3COO– + Na+ CH3COOH CH3COO– + Н+
CH3COONa ® CH3COO– + Na+ CH3COOH CH3COO– + Н+
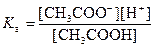
Поскольку диссоциация уксусной кислоты подавлена, то
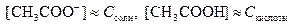 Þ
Þ 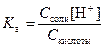 Þ
Þ 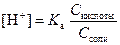
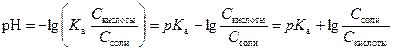
Очевидно, что при разбавлении буферного раствора отношение концентраций кислоты и соли остается постоянным 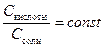 . Следовательно, pH раствора не изменяется.
. Следовательно, pH раствора не изменяется.
В случае основного буфера:
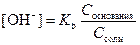 и
и 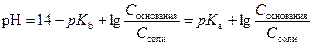 ,
,
Где К а – константа диссоциации кислоты, сопряженной данному основанию (см. теорию Бренстеда-Лоури). Для любой пары всегда верно, что pK a + pK b = 14.
 2020-09-24
2020-09-24 390
390








