Теория Аррениуса
Кислота – вещество, диссоциирующее в растворе с образованием иона водорода (протона) Н+.
HCl ® Н+ + Cl-
Основание – вещество, диссоциирующее в растворе с образованием гидроксидного иона ОН-.
NaOH ® Na+ + OH-
Протолитическая теория (теория Бренстеда-Лоури)
Кислота – донор протонов. Основание – акцептор протонов.
Любой кислоте соответствует сопряженное ей основание и наоборот. Чем сильнее кислота, тем слабее сопряженное ей основание.
HCl ® Н+ + Cl– NH3 + H+ ® NH4+




Протолитическая диссоциация – процесс самоионизации растворителя (воды, жидкого аммиака NH3, жидкого фтороводорода HF и др.:

 H2O + H2O H3O+ + OH–
H2O + H2O H3O+ + OH–
Теория Льюиса
Кислота – акцептор электронной пары. Основание – донор электронной пары.
H+ +: NH3 ® NH4+
кислота основание
Свойства растворов электролитов
Константа диссоциации Кд – характеристика (константа) равновесия процесса электролитической диссоциации; Ка – константа диссоциации кислоты, Кb – константа диссоциации основания.
Ступенчатые константы диссоциации – набор последовательных Кд в случае диссоциации многоосновных кислот или многокислотных оснований.

 (1) H3PO4 H+ + H2PO4-
(1) H3PO4 H+ + H2PO4- 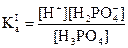
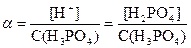

 (2) H2PO4- H+ + HPO42-
(2) H2PO4- H+ + HPO42- 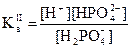

 (3) HPO42- H+ + PO43-
(3) HPO42- H+ + PO43- 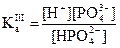
Для любого электролита верно, что 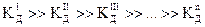 ; следовательно, диссоциация практически останавливается на первой ступени.
; следовательно, диссоциация практически останавливается на первой ступени.
Степень диссоциации α связана с константой диссоциации Кд и молярной концентрацией электролита См:
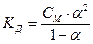
В случае слабого электролита (α << 1), 1 – α ≈ 1 получается
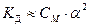 – закон разбавления Оствальда, показывает зависимость степени диссоциации α от концентрации электролита CM.
– закон разбавления Оствальда, показывает зависимость степени диссоциации α от концентрации электролита CM.
 2020-09-24
2020-09-24 142
142








