Чистая вода – слабый электролит, ее диссоциацию можно записать как:

 Н2О Н+ + ОН– К д =
Н2О Н+ + ОН– К д = 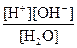 = 1.8∙10–16
= 1.8∙10–16
Степень диссоциации воды чрезвычайно мала (a ®0), поэтому [Н2О] – это практически молярная концентрация чистой воды, которая в любом водном растворе является постоянной и составляет [Н2О] ≈ 55,6 М. Следовательно, Кw = КД∙[Н2О] = const, которую называют ионное произведение воды:
Кw = [Н+ ][ОН–]= 10–14
В нейтральном растворе [Н+ ]=[ОН–]=10–7 М.
Для удобства, вместо величины молярной концентрации протонов и гидроксид-инонов, пользуются водородным показателем pH и гидроксидным показателем pOH:
pН = – lg[H+] рОН= – lg[OH-]
Для любого водного раствора при стандартных условиях верно, что рН + рОН =14.
Водородный показатель характеризует среду раствора:
Ø рН < 7 – кислый раствор;
Ø рН = 7 – нейтральный раствор;
Ø рН > 7 – щелочной раствор.
Экспериментально, водородный показатель раствора рН можно определить с помощью индикатора или рН-метра.
Индикатор – сложная органическая кислота или основание, которое меняет свою окраску при изменении рН раствора.
Гидролиз солей.
Основные понятия
Гидролиз соли – это обменная реакция взаимодействия соли с водой с образованием слабого электролита.
Гидролизу подвергаются все соли, за исключением солей, образованных сильным кислотами и сильными основаниями (растворы таких солей нейтральны, рН ≈ 7).
· Соли, образованные слабыми кислотами и сильными основаниями, подвергаются гидролизу по аниону:

 NaNO2 + H2O HNO2 + NaOH (молекулярный вид)
NaNO2 + H2O HNO2 + NaOH (молекулярный вид)
 NO2– + H2O HNO2 + OH– (ионный вид)
NO2– + H2O HNO2 + OH– (ионный вид)
В результате образования гидроксидных ионов растворы таких солей являются щелочными (рН > 7).
· Соли, образованные слабыми основаниями и сильными кислотами, подвергаются гидролизу по катиону:


 NH4Cl + H2O NH4OH + HCl (молекулярный вид)
NH4Cl + H2O NH4OH + HCl (молекулярный вид)
 NH4+ + H2O NH4OH + H+ (ионный вид)
NH4+ + H2O NH4OH + H+ (ионный вид)
В результате образования протонов растворы таких солей являются кислыми (рН < 7).
· Соли, образованные слабыми основаниями и слабыми кислотами, подвергаются полному (необратимому) гидролизу:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Ступенчатый гидролиз
В случае солей многоосновных слабых кислот или многокислотных слабых оснований гидролиз протекает ступенчато (или, другими словами, происходит ступенчатый гидролиз многозарядного иона):
(I) 


 K3PO4 + H2O K2HPO4 + KOH PO43– + H2O HPO42– + OH–
K3PO4 + H2O K2HPO4 + KOH PO43– + H2O HPO42– + OH–
(II) 

 K2HPO4+ H2O KH2PO4 + KOH HPO42– + H2O H2PO4– + OH–
K2HPO4+ H2O KH2PO4 + KOH HPO42– + H2O H2PO4– + OH–
(III) 

 KH2PO4+ H2O H3PO4 + KOH H2PO4– + H2O H3PO4 + OH–
KH2PO4+ H2O H3PO4 + KOH H2PO4– + H2O H3PO4 + OH–
Гидролиз солей характеризуется константой гидролиза Кг и степенью гидролиза h.
Константа гидролиза КГ – характеристика равновесия реакции гидролиза.
Степень гидролиза – доля частиц, подвергшихся гидролизу.
Например, в случае гидролиза сульфида натрия Na2S:
 (I) S2– + H2O HS– + OH–
(I) S2– + H2O HS– + OH– 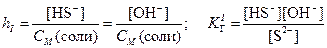
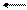 (II) HS– + H2O H2S + OH–
(II) HS– + H2O H2S + OH– 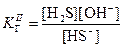
Константа гидролиз связана с ионным произведением воды и соответствующей константой диссоциации слабого электролита. В случае гидролиза сульфида натрия:
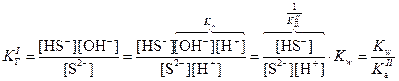
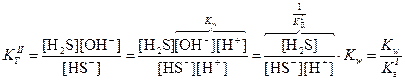
Поскольку 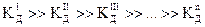 , очевидно, что
, очевидно, что 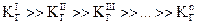 , поэтому в случае таких солей гидролиз протекает только по I ступени.
, поэтому в случае таких солей гидролиз протекает только по I ступени.
Степень гидролиза h связана с константой гидролиза КГ и молярностью раствора соли:
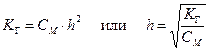 .
.
Гидролиз усиливается:
- при разбавлении раствора;
- при повышении температуры (поскольку реакция гидролиза эндотермическая).
 2020-09-24
2020-09-24 131
131








