Аминокислоты
Все разнообразие веществ пептидной природы основано на 20 аминокислотах, называемых белковыми аминокислотами. Обязательным структурным элементом у них является атом углерода, к которому присоединена аминогруппа и карбоксильная группа, то есть они являются a-аминокислотами. У 19 аминокислот несущий аминогруппу и карбоксильную группу атом углерода замещен еще одним радикалом, из-за чего этот атом становится асимметрическим. Среди белковых аминокислот есть как левовращающие (гистидин, пролин, серин, треонин, фенилаланин), так и правовращающие (аланин, аргинин, глютаминовая кислота, изолейцин, лизин), но все белковые аминокислоты имеют одинаковую пространственную конфигурацию по этому асимметрическому атому углерода. Величина и знак удельного вращения используются в аналитических целях, но при изучении строения производных хиральных молекул гораздо важнее их абсолютная конфигурация.
При рассмотрении пространственной конфигурации углеводов стереоизомеры глицеринового альдегида были представлены в виде фишеровских плоскостных структур. Методом рентгеноструктурного анализа установлено, что у тетраэдрического sp 3-гибридизованного атома углерода при левом расположении гидроксильной группы у левовращающего глицеринового альдегида формильная группа и гидроксиметильная группа расположены за плоскостью, проходящей через асимметрический атом углерода, а атом водорода и гидроксильная группа направлены вперед:

От глицеринового альдегида можно без обращения конфигурации, окислив альдегидную группу до карбоксильной, восстановив гидроксиметильную группу до метильной и заменив гидроксигруппу на аминогруппу, перейти к простейшей аминокислоте с асимметрическим атомом углерода – аланину. При таком превращении оказывается, что выделяемый из белков аланин соответствует по конфигурации L ‑глицериновому альдегиду. То же самое получится и для 18 других оптически активных аминокислот. Две белковые аминокислоты – треонин и изолейцин – имеют еще один асимметрический атом углерода, но и здесь в живой природе встречается только один диастереомер, хотя обычный синтез приводит с равной вероятностью к образованию четырех изомеров, представляющих собой две пары диастереомеров.
В химии аминокислот более удобно изображать пространственное строение этих соединений, помещая в одну плоскость аминогруппу и карбоксильную группу. Тогда атом водорода у L -аминокислот будет расположен за этой плоскостью, а группа R перед ней:
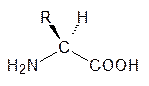
| или | 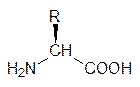
|
Существуют различные классификации белковых аминокислот по заместителям в радикале R, но проще всего различать аминокислоты с нейтральными, кислыми и основными группами в остатках, соединенных с атомом углерода, несущим аминогруппу и карбоксильную группу. К аминокислотам с нейтральными радикалами R относятся глицин (Гли, Gly, G), аланин (Ала, Ala, A), валин (Вал, Val, V), лейцин (Лей, Leu, L), изолейцин (Иле, Ile, I), метионин (Мет, Met, M), серин (Сер, Ser, S), треонин (Тре, Thr, T), цистеин (Цис, Cys, C), фенилаланин (Фен, Phe, F), тирозин (Тир, Tyr, Y), триптофан (Трп, Trp, W), аспарагин (Асн, Asn, N), глютамин (Глн, Gln, Q), пролин (Про, Pro, P). В некоторых классификациях перечисленные аминокислоты подразделяют на полярные и неполярные, но такое выделение неизбежно будет носить субъективный характер. Аминокислоты с карбоксильными группами в радикале R (кислые аминокислоты) – это аспарагиновая кислота (Асп, Asp, D) и глютаминовая кислота (Глу, Glu, E). И, наконец, аминокислоты с основными группами в радикале R – это гистидин (Гис, His, H), лизин (Лиз, Lys, K) и аргинин (Арг, Arg, R).
Обозначения аминокислот трехбуквенными символами используются для краткого изображения олигопептидов, а для полипептидов и белков даже такие символы оказались слишком длинными и сейчас чаще всего используют однобуквенные символы.
Названия аминокислот сложились исторически от греческих корней. Так, глицин, выделенный из продуктов гидролиза желатина, имеет сладкий вкус (гликос); лейцин (лейкос – белый) был выделен из мышечной ткани, тирозин (тирос – сыр) – из казеина, цистин – продукт окисления цистеина – из камней мочевого пузыря (кистос – пузырь) и т.д.
Понятно, что большие молекулы пептидов и белков могут сворачиваться в компактные образования, стабилизированные солевыми связями, водородными связями и гидрофобными взаимодействиями. Роль аминокислот с алифатическими неполярными группами сводится к образованию гидрофобных зон и гидрофобных «карманов» в молекулах белков. Слабые гидрофобные взаимодействия между алифатическими группами позволяют белковым молекулам с минимальным изменением энергии перестраивать третичные структуры в ответ на связывание функциональных групп на поверхности белковой молекулы с соответствующими субстратами или на изменение рН среды. Такие структурные перестройки лежат в основе функционирования рецепторных участков сенсорных клеток, транспортных белков, ферментов и вообще всех проявлений роли белков в живой природе. Аминокислоты аланин (R = CH3), валин (R = (CH3)2CH), лейцин (R = (CH3)2CHCH2) и изолейцин (R = C2H5CH(CH3)CH)
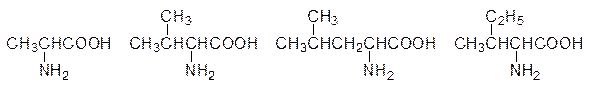
могут быть использованы организмом в качестве источника энергии, но в первую очередь – это основной материал для построения белков мышечной ткани.
Остаток R метионина (R = СH3SCH2CH2 ) также может исполнять роль гидрофобного фрагмента. Так, например, есть две различающиеся только одной аминокислотой молекулы нейропептида энкефалина (пентапептид, участвующий в работе ЦНС) – Мет–энкефалин (Тир–Гли–Гли–Фен–Мет) и Лей–энкефалин (Тир–Гли–Гли–Фен–Лей), из чего следует, что остатки R метионина и лейцина при всем их химическом различии в этом случае играют всего лишь роль гидрофобного фрагмента. Кроме того, метионин входит в состав многих белков с каталитическими функциями. В частности, он служит донором метильных групп при биохимическом метилировании, например, аминогрупп. При этом промежуточным продуктом является S‑аденозилметионин с сульфониевой группой:

При взаимодействии с нуклеофильной молекулой S-аденозилметионин деметилируется и разлагается на аденозин и гомоцистеин (небелковая аминокислота, гомолог цистеина). В растениях S-аденозилметионин превращается в циклопропанаминокарбоновую кислоту, которая служит источником этилена, регулирующего процесс созревания плодов и листопада. Метилирование метионина по атому серы приводит к сульфониевому соединению:

| , |
которое может быть использовано в лечении язвы желудка (его даже называют витамин U от латинского названия язвы – ulcer). В общем случае метионин – это источник сернистых соединений для организма. Очень мало этой аминокислоты в белках сои, поэтому при составлении комбикормов на основе сои добавляют метионин. Метионин – это единственная аминокислота, для которой существует многотоннажное синтетическое производство. Кстати, у метионина нет необходимости в выделении L ‑изомера, поскольку его D -изомер нетоксичен.
Триптофан также может выполнять роль аминокислоты с гидрофобным остатком, но его роль в живой природе далеко выходит за эти рамки. Индольная гетероциклическая система триптофана представляет собой донор электронов для образования комплексов с переносом заряда:
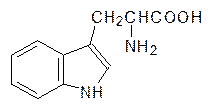
Кроме того, из триптофана образуется переносчик сигналов в ЦНС (нейромедиатор) серотонин и регулирующий сон гормон мелатонин. Экзогенный триптофан можно было бы использовать в качестве пищевой добавки со свойствами успокаивающего средства (транквилизатора), которое из-за его естественного характера, конечно, было бы безопаснее синтетических препаратов. На рынке лекарственных средств триптофан вытеснял обычные транквилизаторы, и фармацевтические фирмы развернули против него широкую кампанию, собрав статистику сомнительного характера о повышенной частоте заболеваний крови у тех, кто употреблял его. Тем не менее на основании этих данных американское Управление по контролю за пищевыми продуктами и лекарственными препаратами (Food and Drug Administration – FDA) запретила использование триптофана в качестве пищевой добавки, и этот запрет действует до сих пор, хотя позже было установлено, что выявленные противопоказания были связаны с употреблением триптофана, произведенного по упрощенной технологии одной японской компанией.
Ароматический цикл фенилаланина (R = С6Н5СН2) также поставляет p‑электроны для образования комплексов с переносом заряда, но в этом он уступает триптофану. Важно, что фенилаланин – это предшественник практически всех биогенных веществ с бензольным циклом. В растениях эта аминокислота служит источником многих окрашенных веществ – антоцианов, флаваноидов. Кроме того, из фенилаланина в клетках растений образуется лигнин – важная составляющая древесины. У животных из фенилаланина через тирозин образуются такие регуляторные вещества, как адреналин и дофамин, гормоны щитовидной железы и другие вещества, например, меланин, окрашивающий кожу и волосы.
В состав многих пептидов с регуляторной и нейромедиаторной активностью входит аминокислота тирозин
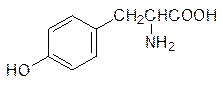
Тирозин образуется при ферментативном окислении фенилаланина, поэтому все, что было сказано выше о фенилаланине, относится и к тирозину.
Амидные группы аспарагина ( R = H2NCOCH2) и глютамина (R = H2NCOCH2CH2 ) играют важную роль в образовании водородных связей в белковых молекулах. Кроме того, амидная группа свободного (то есть не включенного в белковую молекулу глютамина) участвует в детоксикации аммиака, образующегося при дезаминировании аминокислот.
Очень важна гидроксильная группа серина ( R = CH2OH ). В ферментах с гидролазной активностью она находится в каталитическом центре и принимает на себя ацильный остаток гидролизуемого амида или сложного эфира, а сам серин – это исходный продукт для образования глицина, который не только участвует в образовании белков, но и выполняет функцию нейромедиатора торможения в нейронах спинного мозга.
Участие в каталитических процессах гидроксильной группы треонина (R = СН3CHOH ), входящего в состав белковой молекулы фермента, пока не подтверждено, поэтому ее роль, очевидно, заключается только в образовании водородных связей и в гидрофилизации белка.
Аспарагиновая (R = HOOCCH2)и глютаминовая (R = HOOCCH2CH2) кислоты имеют карбоксильные группы, которые не участвуют в образовании пептидных связей. Эти карбоксильные группы предоставляют белкам возможность образования солей с основными группами других фрагментов аминокислот, а также для связывания с основными группами субстратов в активных центрах ферментов. g-Карбоксильная группа глютаминовой кислоты участвует в детоксикации эндогенного аммиака, превращаясь в амидную (глютаминовая кислота превращается в глютамин), кроме того, аминная функция глютаминовой кислоты также включена в процесс обмена аммиака через кетоглутаровую кислоту. Кроме того, глютаминовая кислота – это исходный продукт для образования g-аминомасляной кислоты, выступающей в роли нейромедиатора торможения, а сама глютаминовая кислота – это нейромедиатор возбуждения в ЦНС: до 70% контактов между нейронами ЦНС обеспечиваются этой аминокислотой. Глютаминовая и аспарагиновая кислоты при дезаминировании превращаются в кетоглутаровую и, соответственно, щавелевоуксусную кислоту, которые являются промежуточными продуктами в циклическом превращении лимонной кислоты (цикл Кребса), обеспечивающем энергетику аэробных клеток.
В составе белков аргинин предоставляет для образования солевых связей сильное органическое основание – гуанидиновую группу:
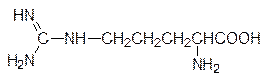
В свободном виде аргинин участвует в циклическом процессе, предназначенном для перевода образующегося в метаболических превращениях аминокислот токсичного аммиака в нетоксичную мочевину. Кроме того, гуанидиновая группа аргинина является единственным эндогенным источником монооксида азота. Исследования последних лет (в 1992 г. монооксиду азота присвоено звание Молекулы года) показали, что монооксид азота участвует в регуляции тонуса кровеносных сосудов (лекарства на основе нитроглицерина и других нитратов). Отмечен положительный эффект диеты с повышенным содержанием аргинина на иммунитет и на состав липопротеинов крови, которые переносят холестерин. Диета для снижения веса также должна содержать повышенные количества аргинина, иначе уменьшение объема жировой ткани будет сопровождаться деградацией мышечной ткани.
В образовании солевых связей в белках участвует еще одна аминокислота – лизин (R = H2NCH2CH2СH2СH2), но в некоторых ферментах ее аминогруппа служит для присоединения простетических групп, выполняющих каталитическую функцию. В качестве пищевой добавки лизин используется для профилактики остеопороза и катаракты. Диета с повышенным содержанием лизина позволяет преодолеть отрицательные воздействия стресса на мышечную ткань, а добавки лизина в количестве 1–3 г в день значительно облегчают течение герпесных инфекций. Лизин, как и метионин, производится в промышленном масштабе для введения в состав комбикормов (очень мало этой аминокислоты в составе белка зерен пшеницы глиадина), но получают его микробиологическим путем.
Аминокислота с самой слабой основной группой – гистидин – играет важную роль в функционировании ферментов. С участием имидазольного фрагмента гистидина идет перенос протонов, например, по схеме

Гистидин относится к незаменимым аминокислотам, однако обычно недостаток в этой аминокислоте не ощущается, в полноценной белковой пище ее вполне достаточно.
К аминокислотам, которые выполняют особую роль в организации структуры белков, можно отнести глицин, пролин и цистеин:
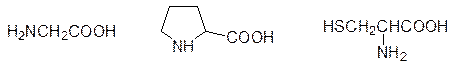
У глицина отсутствует боковой радикал (R = H), и поэтому в белках он обычно играет роль вставки между аминокислотами с объемными радикалами. Что касается пролина, то его пятичленный пирролидиновый цикл имеет углы связей, отличающиеся от углов в молекулах с ациклическими sp 3-гибридизованными атомами углерода. Поэтому остаток пролина в молекуле белка всегда находится в точке изгиба, поворота в ее вторичной структуре. Очень важна в организации третичной структуры белка роль цистеина. Тиольные группы двух фрагментов этой аминокислоты в составе белка легко окисляются с образованием дисульфидных связей (две молекулы цистеина, соединенные дисульфидной связью – это аминокислота цистин). Дисульфидные связи образуют поперечные сшивки между далеко отстоящими друг от друга фрагментами цистеина в пептидной цепи, фиксирующие ее в определенном положении. Этот эффект проще всего демонстрируется на химической завивке волос. Обработка белка волос кератина восстановителем (тиогликолевая кислота) приводит к разрыву дисульфидных связей, что позволяет белковым молекулам скользить относительно друг друга. Затем действие окислителя восстанавливает дисульфидные связи, но после смещения молекул эти мостики возникают уже в других точках, фиксируя новое положение этих молекул, то есть такая завивка обеспечивается новым положением химических связей.
Очень важна лекарственная роль цистеина. N-Ацетилцистеин используется в качестве средства от кашля (препарат АСС), цистеином лечат колиты и потерю волос у женщин. В основе андрогенного облысения лежат мужские гормоны, а у женщин потеря волос чаще всего связана с недостатком серы в пище (диеты!). Однако гораздо важнее участие цистеина в образовании трипептида глютатиона (γ-Глу–Цис–Гли) – регулятора окислительно-восстановительных процессов, антиоксиданта и нейтрализатора попадающих в организм алкилаторов (здесь используется высокая нуклеофильность атома серы в тиольной группе). Недостаток глютатиона в организме приводит к возникновению злокачественных опухолей, к обострению сердечно-сосудистых заболеваний, диабету и артритам. Есть данные о применении глютатиона в терапии ВИЧ-инфекций. Очень важно, что N‑ацетилцистеин повышает уровень глютатиона больше, чем прием более дорогого глютатиона. Одно из современных средств для лечения злокачественных новообразований – реканкостат – представляет собой композицию из цистеина, глютатиона и антоциановых красителей (черника).
Цистеин является также исходным продуктом для образования небелковой аминокислоты таурина (Н2NCH2CH2SO3H), который регулирует транспорт субстратов через клеточные мембраны. Недостаток таурина вызывает болезни сердца, судорожные припадки и нарушения зрения.
Кроме приведенных двадцати аминокислот белки могут также содержать и некоторые другие аминокислоты. Так, например, в состав белка соединительной ткани коллагена входят 5-гидроксилизин и 4‑гидроксипролин (в их образовании из лизина и пролина участвует аскорбиновая кислота). Одним из факторов свертывания крови является гликропротеин протромбин, содержащий g‑карбоксиглютаминовую кислоту. Необычные аминокислоты могут входить в состав пептидов: антибиотик – циклический декапептид грамицидин С (S) – включает две молекулы орнитина (эта аминокислота образуется при гидролитическом отщеплении мочевины от аргинина) и две молекулы D -фенилаланина. В составе многих антибиотиков есть a‑аминоизомасляная кислота. В состав витамина фолиевой кислоты входит 4‑аминобензойная кислота, а другой витамин – пантотеновая кислота – содержит b‑аланин (H2NCH2CH2COOH).
Многие небелковые аминокислоты (их известно около 300) токсичны. Чаще всего их токсичность основана на подобии их структур структурам белковых аминокислот. Системы биосинтеза встраивают их в пептидную цепь вместо соответствующих белковых аминокислот, что приводит к образованию аномальных белков. Таковы, например, пары азетидин-2-карбоновая кислота и пролин, цианаланин и серин:

В организме человека отсутствуют биохимические системы, синтезирующие аргинин, гистидин, валин, лейцин, изолейцин, лизин, метионин, фенилаланин, треонин, триптофан. Эти аминокислоты обязательно должны поступать с пищей и их называют незаменимыми, то есть их недостаток не может покрываться другими белковыми аминокислотами. При поступлении в организм достаточного количества фенилаланина он может превращаться в тирозин и покрывать потребность и в этой аминокислоте, а цистеин можно относить к заменимым аминокислотам только в том случае, когда пища содержит избыточное количество метионина.
С учетом этого условия к заменимым аминокислотам относятся аланин, аспарагиновая кислота, аспарагин, глютаминовая кислота, глютамин, цистеин, глицин, пролин, серин и тирозин, которые могут образовываться в организме человека из других (незаменимых) аминокислот или из других продуктов метаболических превращений.
Недостаток аминокислот в пище и дефицит даже по одной незаменимой аминокислоте приводит к снижению уровня белков в крови, что сопровождается замедлением образования белков в организме. Интересно, что при этом перестают вырабатываться и пищеварительные ферменты (они ведь тоже имеют белковую природу) и тогда нарушается течение пищеварительных процессов, то есть недостаток аминокислот приводит к сокращению их поступления даже в тех случаях, когда они есть в пище, но в неполноценном составе или в дефиците. Недостаток цистеина, особенно на фоне алкогольной интоксикации, вызывает некроз печени, при недостаточном поступлении гистидина и триптофана развивается катаракта, а дефицит по лизину и метионину приводит к анемии. Отечные явления наблюдаются при недостатке треонина (человек «пухнет» от голода). При исключении белков из рациона организм человека начинает терять до 25 г аминокислот в день. Это означает, что замена белковых компонент организма новыми (разбор белков на запчасти) идет так, что остаются «лишние» детали. Дефицитной по отдельным аминокислотам может быть пища растительного происхождения (вегетерианская диета), тогда как белки животного происхождения обычно покрывают потребность в незаменимых аминокислотах, хотя в отдельных случаях, как отмечалось выше, их поступление в организм должно быть повышено.
Если в пище мало даже одной какой-либо незаменимой аминокислоты, то остальные аминокислоты не могут быть ассимилированы в полном объеме и тогда они идут на обеспечение энергетических потребностей или превращаются в жиры. При составлении комбикормов для скота это приводит к непроизводительному расходованию белковой компоненты. Стоит восполнить недостаток в корме несколькими граммами такой дефицитной аминокислоты, как привесы откармливаемого скота заметно возрастают.
Что касается питания человека, то здесь следует принимать во внимание, что наиболее чувствительны к дефициту незаменимых аминокислот дети (болезнь квашиоркор – от африканского языка суахили – является следствием недостатка белковой пищи у детей), но для нормального обмена веществ и взрослые должны получать с пищей немного менее 1 г белков с оптимальным составом аминокислот на 1 кг веса тела в день. Более всего близки к оптимальному составу аминокислот белки яиц и молока. В растительной пище и в соединительной ткани животных чаще всего отсутствуют триптофан, лизин и метионин. Так, например, в картофеле понижено содержание триптофана и метионина, и для покрытия дефицита по этим аминокислотам человеку весом около 70 кг приходилось бы съедать 6 кг картофеля в день. Очень богаты белками семена бобовых, но они дефицитны по лизину, а кукуруза содержит сравнительно много лизина и мало триптофана. Комбинирование бобов и кукурузной муки (индейское блюдо суккоташ) позволяет резко сократить общее потребление этих продуктов питания, поскольку аминокислотный состав комбинированной смеси более близок к идеальному, а энергетические потребности покрываются углеводными составляющими продукта.
Пептиды и белки
В пептидах и белках аминокислоты соединены пептидными связями, которые представляют собой амидные группы, образованные карбоксильными и аминными функциональными группами у асимметрического атома углерода. В соответствии с этим b‑карбоксильная группа аспарагиновой кислоты и g‑карбоксильная группа глютаминовой кислоты, а равно и концевая аминогруппа лизина, в образовании пептидных связей не участвуют. Порядок расположения аминокислот в продукте их поликонденсации с образованием пептидных связей, их последовательность, представляет собой то, что называется первичной структурой белка или пептида
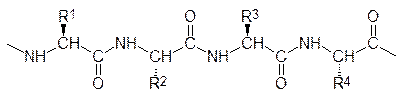
Если пептид содержит не более 20 аминокислот, то его обычно называют олигопептидом, затем идут полипептиды, а от 100 аминокислот начинаются белки. Правда, по некоторым классификациям считается, что полипептиды заканчиваются на 50 аминокислотных компонентах, при этом полагается, что промежуток между ними и белками не заслуживает внимания. В составе белка или пептида аминокислота со свободной a-аминогруппой называется N-концевой аминокислотой, а аминокислота со свободной a-карбоксильной группой – С-концевой аминокислотой. Существуют, конечно, и циклические пептиды, у которых концевые аминокислоты отсутствуют. Первичный порядок пептидов в одно- и трехбуквенном обозначении аминокислот всегда начинается с N‑конца и заканчивается С‑концом. Иногда это подчеркивается тем, что в формуле с трехбуквенным обозначением аминокислот показывают положение аминной и карбоксильной групп, например:
Met-Pro-Cys-Gly или H2N-Met-Pro-Cys-Gly-COOH
В реальных условиях пространственная организация пептидных и, тем более, белковых молекул не может быть линейной. Важную роль в образовании истинной структуры играют водородные связи, которые устанавливаются между атомами водорода NH-групп и атомами карбонильного кислорода в чередующихся амидных связях. В простейшем случае белковая цепь закручивается в спираль, в которой на один виток приходится 3,6 пептидных фрагментов. Шаг такой спирали равен 0,54 нм, радикалы аминокислот R отходят от спирали, как ветви от ствола дерева. Однако такая пространственная организация, получившая обозначение a‑спирали, не может быть образована пептидной цепью из любых аминокислот. У молекулы пролина, как уже отмечалось выше, иной угол связей у атома углерода несущего аминогруппу и карбоксильную группу, и это небольшое различие оказывается достаточно значимым для того, чтобы нарушить регулярность в чередовании пептидных фрагментов в спирали. На этой аминокислоте a‑спираль всегда заканчивается и переходит в другую вторичную структуру. Не помещаются в спирали и расположенные рядом аминокислоты с объемными заместителями, а аминокислоты с основными и кислотными группами редко оказываются включенными в a‑спирали из-за ионных взаимодействий.
Еще одна возможность стабилизации определенной пространственной структуры представлена образованием водородных связей между двумя линейными параллельными или антипараллельными пептидными цепями. Это так называемая складчатая b- структура. В ее состав также могут входить лишь пептидные участки, состоящие из сравнительно простых аминокислот, например аланина, глицина, пролина. В соответствии с принятой классификацией структур белковых молекул a‑спирали, b-структуры и иррегулярные участки представляют собой вторичную структуру белка, а сочетание элементов вторичной структуры в белковой молекуле с участием дисульфидных связей пар цистеиновых фрагментов образуют целостную пространственную третичную структуру белка.
Первым белком, на кристалле которого с помощью рентгеноструктурного анализа была установлена третичная структура, стал миоглобин. Его молекула представляет собой комплекс белка и небелковой гемовой молекулы. Биологическая роль миоглобина заключается в транспорте кислорода внутри клетки к митохондриям и в создании запаса кислорода внутри клетки для восполнения его недостатка в критических ситуациях. Гемовые составляющие присутствуют во многих белках с каталитическими и транспортными функциями. Атом железа, находящийся в центре порфириновой гетероциклической системы гема, может связывать молекулу кислорода или же переносить электроны, меняя валентность от +2 до +3 и обратно. В гемоглобинах, предназначенных для переноса кислорода, у атома двухвалентного железа с координационным числом, равным шести, пять координаций заняты атомами азота: четыре – из порфиринового цикла, пятая в перпендикулярном к плоскости молекулы гема направлении занята атомом азота из имидазольного фрагмента гистидина, входящего в пептидную цепочку белковой компоненты гемоглобина. Шестая координация служит для связывания кислорода. Это положение может заниматься и другими молекулами, так, например, монооксид углерода связывается гемом в гемоглобине в 200–250 раз прочнее, чем кислород.
Расшифровка структуры миоглобина проводилась в несколько этапов. Миоглобин был получен в виде монокристалла и на рентгенограмме низкого разрешения было сначала установлено пространственное расположение полипептидной цепи без учета отходящих от нее радикалов R. Затем в результате съемки с более высокой разрешающей способностью была получена рентгенограмма, позволившая установить положение тяжелых атомов, входящих в состав этих радикалов.
Оказалось, что в миоглобине около 80% всех аминокислотных остатков (всего их 159) включено в восемь почти прямолинейных a-спиралей, из которых самая длинная включает 23 аминокислоты, а самая короткая – 7. Все четыре входящих в состав этого белка молекулы пролина образуют изгиб полипептидной цепи. Все полярные функциональные группы, кроме двух, расположены на наружной поверхности белковой глобулы, а большая часть гидрофобных групп – внутри ее. Молекула миоглобина настолько компактна, что во внутренней сфере могут поместиться всего лишь четыре молекулы воды. Из различных организмов было выделено несколько разновидностей миоглобина, но образуемые ими глобулы очень близки по форме. Оказалось также, что в некоторых ключевых точках полипептидных цепей разных миоглобинов находятся одинаковые аминокислотные последовательности. Такие аминокислоты называют инвариантными.
Третичная структура миоглобина, составленная почти исключительно a‑спиралями, определена его ролью переносчика кислорода. Такая жесткая структура мало приспособлена для многообразных конформационных переходов. В соответствии с этим в молекулах ферментов на долю a-спиралей приходится обычно не более 40% аминокислотных составляющих, но именно a-спирали образуют каталитические центры ферментов и предназначенные для связывания с другими молекулами участки рецепторных и регуляторных белков.
Миоглобин и еще один белок с гемовой составляющей – цитохром с – не содержат складчатых b-структур, но эти элементы третичной структуры белков обязательны для подавляющего большинства ферментов. В качестве примера можно привести защитный белок с гидролазной активностью лизоцим (от греч. lysis – разрыв, растворение). Он содержится в яичном белке, в слезах и в слюне, а его антимикробная активность основана на расщеплении олигосахаридных фрагментов, соединенных со структурными элементами мембран многих бактерий. В b‑структуры лизоцима включено 12% аминокислотных фрагментов, в a‑спирали – 40%, а остальные образуют различные изгибы и иррегулярные участки. Активный центр лизоцима составлен только a-спиралями.
Еще один фермент рибонуклеаза предназначен для гидролитического расщепления рибонуклеиновых кислот. Рибонуклеаза секретируется клетками поджелудочной железы в двенадцатиперстную кишку и поступает в тонкий кишечник. Молекула рибонуклеазы состоит из 124 аминокислот, из которых 26% входят в состав участков, образующих a-спирали, а 35% находятся в b‑структурах. Нативная конфигурация рибонуклеазы поддерживается четырьмя дисульфидными мостиками. Организация третичной структуры белка происходит в процессе его последовательного биосинтеза из аминокислот, а нарушение нативной структуры нагреванием или высокими значениями рН чаще всего приводит к необратимой потере ферментативной активности. Этот процесс называется денатурацией. Однако многие белки с небольшой молекулярной массой в определенных условиях могут подвергаться обратимой денатурации. К таким белкам относится и рибонуклеаза.
При обработке рибонуклеазы концентрированным раствором мочевины (разрыв водородных связей между пептидными функциональными группами) и меркаптоэтанолом (разрыв дисульфидных связей) белковая цепь рибонуклеазы разворачивается и теряет каталитическую активность, поскольку в этом случае пространственная организация активного центра оказывается полностью нарушенной. Если денатурированную таким мягким способом рибонуклеазу подвергнуть диализу, то есть с помощью полупроницаемой мембраны отмыть от нее мочевину и избыток меркаптоэтанола, то она почти полностью (на 95%) восстановит каталитическую активность, а через некоторое время в процессе окисления кислородом воздуха восстановятся дисульфидные мостики и структура белка стабилизируется. После этого рибонуклеаза станет гораздо более устойчивой к внешним воздействиям, чем без этих жестких сшивок, поддерживающих оптимальную третичную структуру.
Интересно, что простой вероятностный перебор вариантов самоорганизации белка из 100 пептидных фрагментов для получения конфигурации с минимумом энергии занял бы 1050 лет. Очевидно, правильная укладка небольшого участка полипептидной цепи значительно упрощает организацию расположенных рядом участков, и чем больший участок белковой молекулы принял оптимальную структуру, тем скорее в этот процесс вовлекаются остальные участки. Простота такой самоорганизации денатурированного щадящими способами белка может быть связана и с тем, что в нем сохраняются определенные критические структурные элементы, вокруг которых затем и идет ренатурация.
В связи с этим понятно, что расшифровка генетического кода пока не может быть эффективно использована для получения белков с правильной третичной структурой. Здесь можно вспомнить, что ДНК кроме значащих участков содержит так называемые интроны, вычленить которые на основании формальных признаков без ошибок не так просто. Если это все же удастся, то самопроизвольное сворачивание синтезированной в соответствии с кодонами ДНК белковой молекулы в требуемую для правильного функционирования белка пространственную структуру (фолдинг) еще менее вероятно.
По строению белки разделяются на две основные группы – фибриллярные (нитевидные) и глобулярные (овальной или округлой формы).
По биологической функции можно выделить следующие группы белков:
· ферменты;
· транспортные белки (гемоглобин, сывороточный альбумин, липопротеины);
· пищевые или запасные белки (глиадин из зерен пшеницы, яичный альбумин, казеин);
· сократительные и двигательные белки (актин, миозин, тубулин);
· структурные белки (коллаген, эластин, кератин, фиброин);
· защитные белки (антитела, тромбин, токсины, например, токсин ботулизма, рицин, яды змей и паукообразных);
· регуляторные белки (инсулин, кортикотропин, репрессоры и др.).
Белковые молекулы в биологических объектах всегда находятся в состоянии сборки и разборки, что объясняет присутствие в клетках как свободных аминокислот, так и очень большого числа пептидных молекул различного размера в разных концентрациях. Так, например, в клетках можно с помощью экстракции и хроматографии обнаружить около 100 пептидов с концентрацией, превышающей 100 пмоль/г, с концентрацией от 10 до 100 пмоль/г их уже около 1000 и еще на порядок возрастает число пептидов, содержание которых не превышает 1 пмоль/г. Понятно, что состав пептидов в значительной мере зависит от способов их выделения.
Многие аминокислоты выполняют определенные метаболические и регуляторные функции, и поэтому их роль не ограничивается только участием в биосинтезе белков в качестве их структурных элементов.
Постоянно расширяются знания о регуляторной роли пептидов. Многие из них играют роль гормонов. Сравнительно простое соединение – глютатион, представляющий собой ацилированный g-карбоксильной группой глютаминовой кислоты цистеинилглицин, защищает все живые клетки от алкилаторов, окислителей и свободных радикалов. Пентапептид энкефалин Тир–Гли–Гли–Фен–Мет выполняет функцию нейромедиатора в нервной системе человека, то есть это вещество участвует в межнейрональных взаимодействиях. Из мозга быка выделен дипептид киоторфин с аналогичной ролью (Тир–Арг), а у насекомых нейромедиатором является пентапептид проктолин Арг–Тир–Лей–Про–Тре.
Проявляют биологическую активность и некоторые пептиды, образующиеся при неполном ферментативном гидролизе белков и полипептидов. Так, например, сравнительно устойчивы к действию пищеварительных ферментов продукты протеолиза казеина b-казоморфины Тир–Про–Фен–Про–Гли–Про–Иле (из молока коровы) или Тир–Про–Фен–Вал–Глу–Про–Иле (из материнского молока).
Эти вещества могут поступать в кровь из пищеварительной системы, особенно легко они всасываются стенками кишечника детей. Казоморфины оказывают мягкое снотворное и успокаивающее действие, являясь аналогами (агонистами) нейромедитатора энкефалина.
При гидролизе адренокортикотропного гормона (АКТГ), состоящего из 39 аминокислот, образуется тетрапептид Мет–Глу–Гис–Фен, стимулирующий высшую нервную деятельность. Многие продукты неполного протеолиза белков являются иммуномодуляторами, например, тафцин Тре–Лиз–Про–Арг. Этот тетрапептид также улучшает познавательные функции ЦНС.
Пептидами являются также некоторые антибиотики.
ГЛАВА 5. ФЕРМЕНТЫ
Вещества белковой природы, катализирующие химические превращения в живых клетках, называют ферментами или энзимами. Эти понятия имеют не просто лингвистическое расхождение. На начальном этапе развития биохимии в 50-е гг. XIX в. шел спор между Л. Пастером с одной стороны и П. Бертло и Ю. Либихом с другой. Пастер был убежден в том, что процесс брожения неотделим от дрожжевых клеток и осуществляющие это превращение катализаторы – организованные ферменты (от лат. fermentum – закваска) – от клеток неотделимы. Бертло и Либих оперировали понятием энзим (от греч. en – в, zyme – закваска, то есть то, что в закваске), относя его к секретируемым клетками катализаторам пищеварительных процессов: пепсину, трипсину, амилазе и др. Позиция Пастера основывалась на том, что он проводил стерилизацию клеточных культур нагреванием, при котором шла и денатурация ферментов, а Бертло и Либих работали с ферментами из пищеварительных соков, не проводя их термическую обработку. В соответствии с этим биокатализаторы вне продуцирующей их клетки принято называть энзимами. Это означает, что биокатализаторы в составе стирального порошка, в названии которого есть приставка «био», или в таблетке фестала можно называть энзимами, в то же время в биохимии, рассматривающей обменные процессы в клетках, говорят обычно о ферментах, хотя относящийся к ферментам раздел биохимии называют энзимологией для того, чтобы понятие было составлено из слов только одного языка (в данном случае греческого).
Работу ферментов выбрал для иллюстрации особенности биохимических процессов известный биохимик А. Сент-Дьерди. Во введении к своей книге по биохимии он напомнил, что в гробнице Тутанхамона несколько тысяч лет пролежала высохшая трапеза фараона, оставленная ему для загробной жизни. Будучи съеденной, она превратилась бы в диоксид углерода, воду и другие продукты метаболизма в считанные часы.
Надо сказать, что начало биохимии в нашем сегодняшнем понимании было положено работами Э. Бухнера (1898 г.), показавшего, что после длительного перемешивания дрожжевых клеток с инфузорной землей происходит их разрушение, но полученный бесклеточный сок некоторое время сохраняет способность к сбраживанию глюкозы. На самом деле аналогичные опыты ставились намного раньше, например, за 25 лет до публикации Бухнера появилась статья на эту тему М. Манасеиной (Коркуновой) на русском и немецком языках; были и более ранние сообщения.
Что же отличает ферменты как катализаторы? В общем можно выделить три особенности этих катализаторов:
1. Высокая эффективность. Под этим подразумевается, что реакции, которые в обычных условиях идут очень медленно или вообще не идут, в присутствии ферментов протекают с очень высокой скоростью. (Правда, скорость при этом понятие относительное. Если одна молекула пепсина вызывает расщепление примерно десяти пептидных связей в секунду, то молекула каталазы, разлагающая пероксид водорода на воду и кислород, осуществляет десятки тысяч превращений в секунду.)
2. Ферменты высокоспецифичны по типу реакций, то есть каждый фермент катализирует только одну реакцию, например, глютаминовая кислота в присутствии соответствующей декарбоксилазы превращается в g-аминомасляную кислоту, а в присутствии фермента, относящегося к трансаминазам, из нее образуется кетоглутаровая кислота.
3. Ферменты чаще всего специфичны, избирательны по субстрату. Например, превращение гидроксильной группы в карбонильную осуществляют ферменты, относящиеся к дегидрогеназам, но этанол превращается в ацетальдегид алкогольдегидрогеназой, а молочная кислота в пировиноградную – лактатдегидрогеназой. Хотя, конечно, есть и ферменты с невысокой избирательностью, например, пищеварительные.
Из этого следует, что ферментов, осуществляющих все многообразие метаболических превращений, должно быть очень много. В 1930 г. было известно всего лишь 80 ферментов, а в 1994 г. уже около 3200. Долгое время безуспешно искали ферменты не только среди белков, но и среди других классов биополимеров и лишь в последние годы было показано, что превращения определенных субстратов могут катализировать и некоторые рибонуклеиновые кислоты, названные рибозимами.
Ферменты, выделенные и охарактеризованные на ранней стадии развития биохимии, получали имена собственные (трипсин, пепсин, тромбин), затем названия ферментов стали образовывать по названию субстратов с окончанием - аза (аргинин ® аргиназа, аспарагин ® аспарагиназа, мочевина ® уреаза и т.д.). Сейчас название субстрата чаще всего дополняют типом осуществляемого ферментом химического превращения (лактатдегидрогеназа, холинэстераза, супероксиддисмутаза). Обилие таких названий может напугать приступающего к изучению биохимии, но этот испуг легко преодолим, так как, в конце концов, даже специалисты имеют обычно дело с ограниченным числом биохимических превращений. Если выделять из биохимии раздел энзимологии, то такая путаница в названиях становится слишком обременительной, и поэтому была принята цифровая классификация ферментов, включающая четыре группы цифр: класс, подкласс, подподкласс и номер фермента в подподклассе. Исторически выделилось шесть классов ферментов.
Первый класс представляют оксидоредуктазы. В их число входят, например, дегидрогеназы, то есть ферменты, катализирующие дегидрирование спиртовых групп до карбонильных групп, окисление карбонильных групп до карбоксильных, дегидрирование с образованием этиленовых соединений, дегидрирование групп СН‑NН2, приводящее к образованию иминов (C=NH), и т.д. Реакции дегидрирования протекают по схеме:
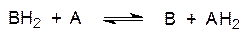
Чаще всего в роли акцепторов водорода выступают небелковые молекулы (коферменты), входящие в состав дегидрогеназ. Если атомы водорода или электроны непосредственно переносятся на кислород, то такие ферменты относятся к подклассу оксигеназ.
Второй класс представляют трансферазы – это ферменты, катализирующие перенос многоатомных групп с одной молекулы на другую. В их число входят, например, ферменты, переносящие фосфатные остатки с аденозинтрифосфата на молекулы сахаров (фосфофруктокиназа), ферменты, переносящие одноуглеродные фрагменты (фолатзависимые ферменты). К трансферазам относятся также трансаминазы, обменивающие аминогруппы на карбонильные функциональные группы.
Ферменты третьего класса – это гидролазы. Они катализируют перенос двух фрагментов расщепляемой молекулы на молекулу воды, то есть реакцию гидролиза. Если они гидролизуют пептидные связи в белках, то это протеазы или пептидазы. Отщепление С‑концевой аминокислоты катализируют карбопептидазы, а N-концевой – аминопептидазы. Гидролитическое расщепление нуклеиновых кислот идет в присутствии нуклеаз (ДНКаза, РНКаза).
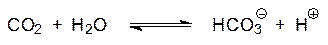
Четвертый класс ферментов – это лиазы. Они катализируют расщепление субстрата с образованием кратной связи или в обратном направлении – присоединение по кратной связи (в этом варианте обратной реакции их называют обычно синтазами). В качестве примера можно привести карбоангидразу, катализирующую реакцию образования бикарбоната из диоксида углерода и воды:
К пятому классу относятся изомеразы. Уже их название характеризует тип катализируемых этими ферментами превращений. Можно только добавить, что наряду с простой изомеризацией, связанной, например, с переносом ацильной (фосфорильной) группы с одной гидроксильной группы на другую, изомеразы катализируют и более сложные реакции. Например, к ним относятся рацемазы и эпимеразы (если речь идет об образовании другого диастереоизомера), а кобаламинзависимые изомеразы по радикальному механизму катализируют и перестройку углеродного скелета молекул. С их участием, например, метилмалоновая кислота в виде ее тиоэфира с коферментом А превращается в сукцинил-кофермент А:
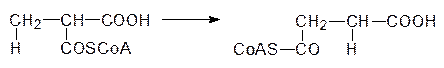
Шестой класс ферментов – это лигазы (синтетазы). Главная особенность этих ферментов состоит в том, что энергию, требуемую для протекания катализируемых ими превращений, поставляют так называемые макроэргические вещества, главным из которых является АТФ. Примером катализируемых лигазами реакций служит образование C–N-, C–S- и С–С-связей (например, пептидных связей, тиоэфиров).
Набор функциональных групп в белковых аминокислотах невелик, и с их помощью белковая молекула не может обеспечить катализ всех необходимых для протекания метаболических процессов реакций. Вследствие этого во многих случаях к работе ферментов подключаются вещества небелковой природы, которые могут быть связаны с белковой молекулой ковалентными связями, ионными связями или же они могут образовывать более или менее прочные комплексы с белковой частью фермента, которую называют апоферментом. Если небелковая составляющая фермента связана с белком ковалентной связью, то ее называют простетической группой, а связанную с апоферментом водородными связями, ионными, ван-дер-ваальсовыми или гидрофобными взаимодействиями небелковую компоненту называют коферментом (в последнее время входит в употребление термин косубстрат, то есть дополнительный, вспомогательный субстрат). Обладающий каталитической активностью комплекс кофермента и апофермента, если это надо подчеркнуть, называют холоферментом. Коферменты или простетические группы отвечают за химизм катализируемого превращения. Образование холофермента стабилизирует апофермент, поскольку при этом реализуется наиболее выгодная в энергетическом отношении структура. Но белковая компонента не только определяет специфичность фермента по субстрату, обеспечивает связывание с субстратом и отход от каталитического центра продуктов реакции. В отдельных случаях, как отмечалось выше, она определяет и химизм катализируемой реакции. Кроме коферментов или простетических групп в состав ферментов могут входить и кофакторы – чаще всего это ионы металлов, известные нам как микроэлементы.
Существуют также ферменты, каталитический центр которых составлен только функциональными группами аминокислот, но и они чаще всего наиболее активны при наличии в их структуре кофакторов. Так, например, в каталитическом центре сериновых гидролаз находится ион цинка.
Особую роль в метаболических процессах играют аллостерические ферменты, молекулы которых, кроме каталитических центров, имеют еще и регуляторные участки. В результате связывания с ними веществ, называемых эффекторами, активность фермента может возрастать (положительный эффектор) или снижаться (отрицательный). Аллостерические ферменты отличаются более сложным строением и более высокой молекулярной массой.
Строение многих коферментов и простетических групп было установлено еще в 1930-е гг. Оказалось, что чаще всего они образуются в результате более или менее сложных биохимических превращений витаминов. Так, например, витамин В1 (или тиамин), входит в состав лиаз, декарбоксилирующих a-кетокислоты (пируватдекарбоксилаза, пируватдегидрогеназа, кетоглутаратдегидрогеназа), в виде эфира с пирофосфорной кислотой – тиаминпирофосфата (ТПП):
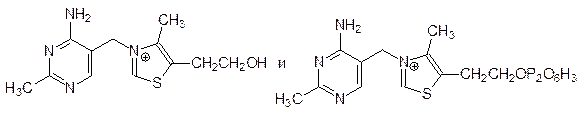
Кофермент пиридоксальфосфат, принимающий участие в реакциях переаминирования (трансаминазы) и декарбоксилирования аминокислот (лиазы), образуется в результате монофосфорилирования витамина В6 – пиридоксаля:
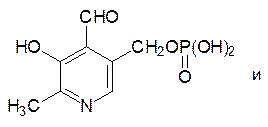
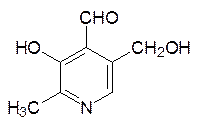
Более сложная цепочка превращений идет от никотинамида (витамина В3) к коферменту реакций гидрирования-дегидрирования – никотинамидадениндинуклеотиду NAD+ (никотинамид и никотиновую кислоту сейчас принято назвать ниацином):
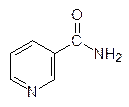
| и | 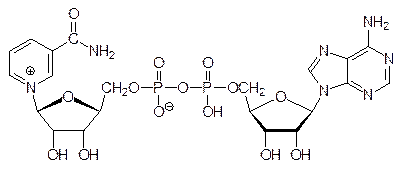
|
Еще одна группа ферментов, принимающих участие в реакциях гидрирования-дегидрирования, представлена флавопротеинами (FMN и FAD, флавинмононуклеотид и флавинадениндинуклеотид), у которых доноромакцептором атомов водорода является рибофлавиновый структурный элемент, поступающий в организм в виде витамина В2, его окислительно-восстановительное превращение протекает по схеме:
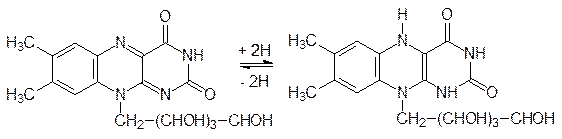
Важную роль в биологических системах играют цитохромы (от греч. kytos (цитоc) – вмещающее, клетка; chroma (хрома) – цвет, окрашивание). В их состав входят железопорфирины, которые представлены макроциклами из четырех связанных метиновыми мостиками пиррольных колец с атомом железа в центре. В качестве примера приведем структуру гема – железопорфирина, входящего в состав гемоглобина и предназначенного для переноса молекулярного кислорода.
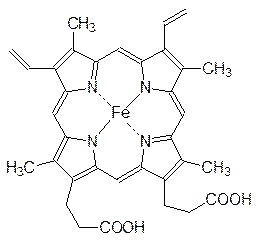
Гем соединен с белковыми молекулами тиоэфирными связями, образовавшимися в результате присоединения сульфгидрильных групп из остатков цистеина по винильным группам гема.
Содержащие гемовые структуры цитохромы оксидоредуктаз, окрашенные в цвета от красного до коричневого, участвуют в переносе электронов (Fe+2 ® Fe+3 + e–), например, когда образовавшиеся в реакциях дегидрирования атомы водорода отдают соответствующим акцепторам свои электроны и превращаются в протоны. Цитохромы обозначают буквами латинского алфавита с цифровыми индексами (а, а3, b, c1, с, f6), всего их известно более двадцати. В частности в цитохроме с феррипорфириновый фрагмент в отличие от гема вместо остатков пропионовой кислоты содержит пропильные группы. Цитохромы участвуют также в реакциях окислительного гидроксилирования органических соединений, а пара цитохромоксидаз а и а3 переносит четыре электрона на молекулу кислорода (аэробные процессы).
В некоторых учебниках по биохимии в качестве универсального кофермента реакций гидрирования-дегидрирования рассматривается также убихинон (от лат. ubi – везде, то есть вездесущий хинон). На самом деле существует несколько соединений этого класса с алкенильными заместителями на основе олигомеров изопрена различной длины (их иногда называют витаминами Q), например:
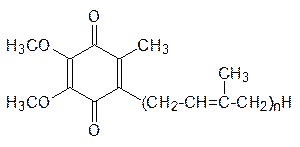
В частности, из печени млекопитающих выделен убихинон с n = 10, однако это соединение с гидрофобным разветвленным алкильным остатком из 50 атомов углерода не предназначено для связывания с белками и поэтому не может претендовать на роль истинного кофермента. Убихинон входит в состав пигментов электронпереносящей цепи в мембранах митохондрий. Аналогичный по строению хинон переносит электроны в мембранах хлоропластов в клетках растений при фотосинтезе.
Фолиевая кислота (витамин Вс)
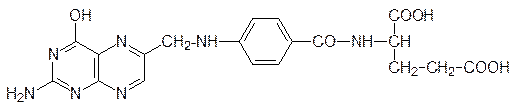
после ее превращения в тетрагидрофолиевую кислоту участвует в работе ферментов, переносящих одноуглеродные фрагменты. Так, например, с участием фолатзависимого фермента серин превращается в глицин:
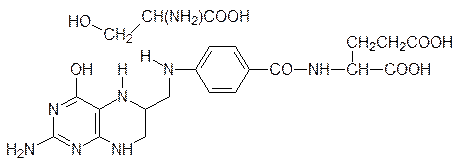
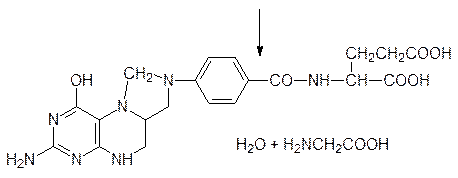
В работе ацилтрансфераз принимает участие кофермент А, обозначаемый CoA‑SH. В этом соединении 3¢‑фосфоаденозиндифосфат соединен его пирофосфатным фрагментом с 2-меркаптоэтиламидом пантотеновой кислоты, которая является обязательным фактором питания (витамин В5):

3-Гидроксипропиламид 2,4-дигидрокси-3,3-диметилмасляной кислоты (пантоевой кислоты) используют для лечения ран и других поражений кожных покровов под торговым названием пантенол:
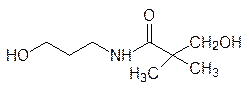
В этом соединении 3-гидроксиэтиламидный остаток окисляется и превращается в остаток b-аланина, то есть пантенол – это провитамин В5.
С участием АТФ или в результате обменной реакции с другим тиоэфиром кофермент А ацилируется по сульфгидрильной группе с образованием тиоэфира, например ацетилкофермента А (СоА–S–СОСН3), и снова может переносить ацильные группы на другие молекулы по различным механизмам.
Биотин, или витамин Н,
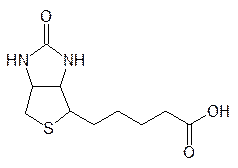
выполняет роль простетической группы у карбоксилаз, относящихся к лиазам. Витамин Н достаточно стабилен и авитаминоз по нему встречается только у людей, которые едят много сырых яиц, так как яйца содержат белок, который связывает биотин в прочный комплекс. Биотин присоединен к белковой составляющей фермента путем образования амидной связи между карбоксильной группой биотина и концевой аминогруппой лизинового фрагмента в молекуле белка. Это связано с тем, что мочевинный участок бициклической системы простетической группы должен с минимальной структурной перестройкой перемещаться на таком поводке из десяти атомов из одного активного центра фермента в другой, так как механизм его действия основан на двух реакциях. Сначала протекает реакция карбоксилирования бикарбонатом с участием АТФ:
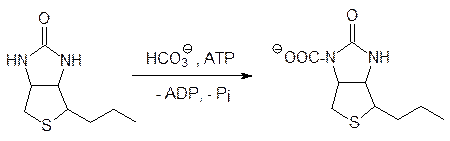
После этого уже в другом участке фермента карбоксильная группа переносится на другую молекулу. Например, так из пропионил-кофермента А образуется метилмалонил-СоА:
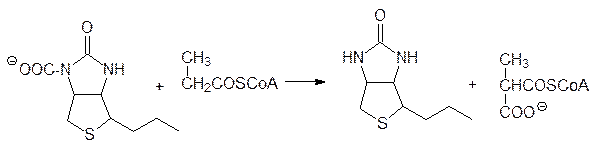
Одним из наиболее изучаемых витаминов является витамин С – аскорбиновая кислота, однако ее роль в функционировании ферментов до сих пор не установлена во всех ее проявлениях. Предполагается, что аскорбиновая кислота участвует в образовании входящих в состав коллагена (белок соединительной ткани) 4‑гидроксипролина и 5‑гидроксилизина, и поэтому ее присутствие важно для заживления ран. Не исключено и участие аскорбиновой кислоты в ассимиляции неорганического железа.
Сложное строение отличает группу веществ, относящихся к витаминам В12. Чаще всего витамин В12 представлен кобальторганическим соединением, известным под названием цианкобаламин, раствор которого в воде окрашен в пурпурный цвет. Он выполняет роль кофермента изомераз, функционирующих по радикальному механизму. Источниками кобаламина являются бактерии, в частности бактериальная флора пищеварительного тракта; в растениях витамин В12 отсутствует. В этом соединении атом кобальта встроен в систему из четырех гидрированных пиррольных колец на основе порфиринов:
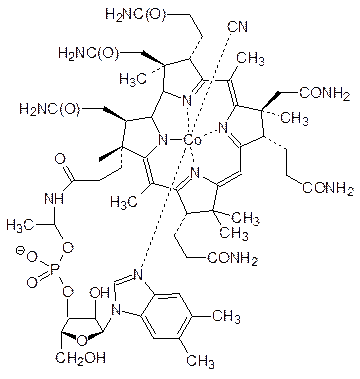
Наиболее ярко авитаминоз по В12 проявляется в нарушении процесса кроветворения.
Из других обязательных факторов питания можно назвать витамин А, или ретинол:
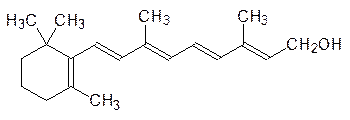
В организме витамин А выполняет несколько функций. Наиболее известна его роль в зрительном процессе, где он в виде ретиналя, образующегося при дегидрировании ретинола, участвует в образовании реагирующего на свет пигмента родопсина. Но дефицит по витамину А не ограничивается только «куриной слепотой», это всего лишь первый симптом авитаминоза по этому веществу. При недостаточности витамина А появляется сухость кожи, глаз (ксерофтальмия), задержка развития и роста, стерильность самцов. Но и гипервитаминоз опасен, особенно для беременных женщин.
Витамин Е, или токоферол (от греч. токос – потомство, феро – несу),
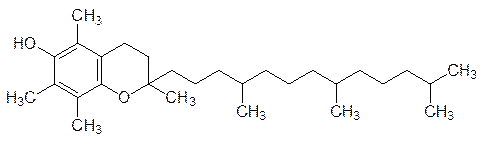
не является коферментом, он ингибирует реакции с участием свободных радикалов. Его недостаток в рационе вызывает перерождение репродуктивных органов, нарушение функций мембран, дегенерацию печени, но точная биологическая роль витамина Е не установлена. Много этого витамина содержится в растительных маслах. Синтетический витамин Е, идентичный натуральному, добавляют сейчас в пищевые продукты для замедления процессов полимеризации и окисления.
Витамины группы D (они, как отмечалось выше, образуются из эргостерина) относятся скорее к гормонам, так как они регулируют обмен кальция и фосфата.
Витамин К – замещенный метилнафтохинон – влияет на свертываемость крови, правда, и в этом случае механизм его участия в образовании одного из них – протромбина – не установлен.
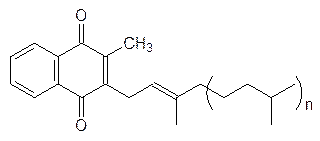
Кинетическое описание ферментативных реакций было предложено Л. Михаэлисом и М. Ментен. В 1913 г. эти исследователи предположили, что фермент (Е) и субстрат (S) образуют комплекс (ES, комплекс Михаэлиса):
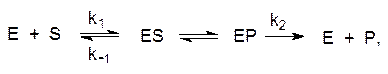
который превращается в комплекс фермента с продуктом превращения субстрата (ЕР), распадающийся далее на фермент (Е) и продукт (Р).
Основа катализа – снижение энергии активации реакции, и ферменты по способности снижать ее превосходят все известные катализаторы. Так, например[1], разложение пероксида водорода без катализатора требует энергии активации 18000 кал/моль, самый активный неорганический катализатор – коллоидная платина – снижает ее до 11700 кал/моль, а фермент каталаза обеспечивает снижение энергии активации до менее 2000 кал/моль. Этиловый эфир масляной кислоты гидролизуется в присутствии кислот с энергией активации (Е А) 16800 кал/моль, щелочи снижают значение Е А до 10200 кал/моль, а панкреатическая липаза (пищеварительный фермент, секретируемый поджелудочной железой) характеризуется энергией активации по этому субстрату, равной 4500 кал/моль. Очень медленно гидролизуется водой сахароза, в присутствии кислот этот процесс ускоряется (Е А = 25600 кал/моль), а дрожжевая инвертаза снижает этот показатель реакции до 8000–10000 кал/моль. В абсолютных величинах это различие выглядит не очень серьезным, но энергия активации в уравнении Аррениуса входит в экспоненциальный множитель
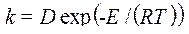 ,
,
и тогда константа скорости ферментативной реакции (kе) в логарифмическом виде представляется уравнением (Е А = 8000 кал/моль)
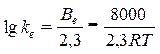 ,
,
а константа скорости реакции, катализируемой протонами (kh), уравнением (Е А = 25600 кал/моль)
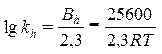 .
.
Постоянные реакций Вe и Вh примерно равны, и тогда для температуры 37°С получаем
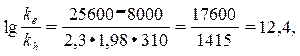
что соответствует отношению ke / kh = 2,5×1012 (двенадцать порядков!).
В чем же заключается уникальная избирательность и высокая каталитическая активность ферментов? Прежде всего – в особенности пространственного строения белковой молекулы, лежащего в основе этих катализаторов. Форма глобулярного белка во многом определяется гидрофобными взаимодействиями между структурными элементами входящих в его состав аминокислот. Эти взаимодействия слабы, но когда их много – они дают достаточно значимый выигрыш в энергии. Гидрофобные структурные элементы заполняют внутреннюю среду белковой глобулы, однако слабость каждого отдельного взаимодействия позволяет белку в ответ на воздействие на внешнюю сферу (в результате изменения рН или присоединения другой молекулы) легко перестраиваться, принимая новую форму и меняя местами различные функциональные группы боковых цепей аминокислотных фрагментов. Еще Фишер выдвинул гипотезу о взаимодействии субстрата с активным центром фермента по принципу «ключ-замок». Очень часто и сейчас используют это представление для схематической иллюстрации ферментативного катализа. Однако этот подход слишком упрощен, он не отражает того, что в ответ на связывание с субстратом происходит перестройка белковой молекулы фермента, и тогда образующемуся комплексу субстрата с ферментом соответствует минимум энергии уже при ином расположении составляющих фермент структурных элементов, а по мере протекания ферментативной реакции такие перестройки белковой молекулы могут происходить неоднократно до отхода продукта реакции от реакционного центра.
В разделе, посвященном строению белков, уже были представлены данные по третичной структуре миоглобина, рибонуклеазы и лизоцима. Активный центр лизоцима представлен только a-спиралями. Расстояние, равное шагу a-спирали (0,54 нм) или кратное ему, разделяет атомы с повышенной или с пониженной электронной плотностью во многих субстратах или биологически активных веществах.
Одной из главных особенностей ферментов является реализуемая с их помощью возможность использования свободной химической энергии, заключенной в таких макроэргических веществах, как аденозинтрифосфат, для осуществления эндотермических реакций, а также синтез аденозинтрифосфата за счет использования энтропийного фактора. Однако и без этого ферменты представляют собой уникальные катализаторы, специфику которых объясняют перечисленными далее механизмами.
 2020-10-10
2020-10-10 240
240








