Одна из главных особенностей ферментативного катализа заключается в эффекте сближения реагирующих групп. В результате взаимодействия субстрата с его окружением в активном центре реагирующие группы оказываются в наиболее благоприятном для протекания реакции положении. Этот эффект наблюдается и в обычной органической химии. Так, например, реакция гидролиза п ‑бромфениловых эфиров карбоновых кислот катализируется карбоксилатными ионами:
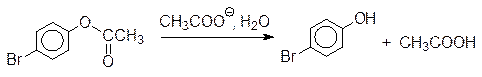
Если скорость гидролиза п -бромфенилацетата в присутствии эквивалентного количества ацетата натрия принять за единицу, то соль моно- п -бромфенилового эфира глутаровой кислоты гидролизуется примерно в 1000 раз быстрее, в 2,2×105 раза быстрее гидролизуется соль соответствующего моноэфира янтарной кислоты:

Для моно- п -бромфенилового эфира малеиновой кислоты скорость гидролиза возрастает в 107 раз. Интересно, что для солей моно- п -бромфениловых эфиров некоторых 2,2‑дизамещенных глутаровых кислот скорость гидролиза может увеличиваться в 3×1018 раз. Это связано с уменьшением степеней свободы при вращении молекул, что обеспечивает оптимальное расположение катализирующей гидролиз анионной карбоксилатной группы около сложноэфирной группы.
Еще один пример рассматриваемого эффекта представлен реакцией гидролиза гликозидов 2-гидроксибензойной кислоты (салициловой) и 4-гидроксибензойной кислоты. Скорость гидролиза первого соединения на 4 порядка выше, чем второго:

Здесь очевидна каталитическая роль кислотной группы, которая у производного салициловой кислоты находится непосредственно у аномерного (гликозидного) атома кислорода.
И последний пример: известно, что прямая реакция этерификации фенола карбоновыми кислотами идет крайне медленно, но в то же время 2‑гидроксикоричная кислота циклизуется в лактон (кумарин) даже в щелочной среде:

 2020-10-10
2020-10-10 329
329








