Ингибирование ферментов представляется важным как с токсикологической, так и с фармакологической точек зрения. Особое место занимают процессы необратимого ингибирования ферментов. Чаще всего это связано с нарушением нативной структуры апофермента. В частности, такими ингибиторами являются ионы тяжелых металлов, образующих прочные связи с сульфгидрильными группами, алкилаторы, например иодуксусная кислота, которая реагирует по имидазольным фрагментам белка (из гистидина) и по другим нуклеофильным центрам. Необратимыми ингибиторами металлопротеиновых ферментов (каталаза, супероксиддисмутаза) являются сильные восстановители (арсин, фосфин), которые изменяют валентность ионов участвующих в катализе металлов (марганец, кобальт, железо), переводя их даже в металлическое состояние, а также некоторые кислоты (сероводород, синильная кислота), образующие прочные соли с этими металлами. Однако возможны необратимые блокировки ферментов и в результате превращения простетических групп и коферментов. Так, например, гидразиды кислот реагируют с формильными группами в активном центре пиридоксальфосфатзависимых трансаминаз и декарбоксилаз с образованием стабильных гидразонов и нарушают, в частности, биосинтез аминных нейромедиаторов, участвующих в передаче нервных импульсов.
С фармакологической точки зрения наиболее интересны обратимые ингибиторы ферментов. Причем здесь можно выделить три вида ингибирования – конкурентное, неконкурентное и бесконкурентное. В случае конкурентного ингибирования речь идет о включении в активный центр фермента вещества, строение которого подобно строению естественного субстрата (метаболита), поэтому такие вещества часто называют антиметаболитами. В качестве примера можно привести реакцию дегидрирования янтарной кислоты сукцинатдегидрогеназой, протекающую по схеме:

Эта реакция блокируется многими соединениями, сходными по строению с янтарной кислотой, но не способными к реакции дегидрирования. Антиметаболитами янтарной кислоты являются малоновая, щавелевая, глутаровая, фенилпропионовая кислоты. В частности, сродство малоновой кислоты к активному центру фермента даже выше, чем у естественного субстрата: 50%-е ингибирование фермента происходит при концентрации малоната в 50 раз ниже концентрации сукцината. При конкурентном ингибировании пониженную ингибитором скорость реакции можно повысить до прежнего значения повышением концентрации субстрата.
Еще один пример – антиметаболит фолиевой кислоты метотрексат:
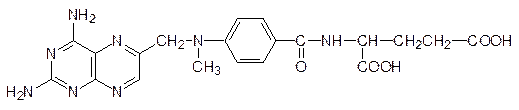
Тетрагидрофолиевая кислота переносит одноуглеродные фрагменты с образованием пятичленного цикла (см. стр. 106), а ее структурный аналог с третичной аминной группой, который может образовываться из метотрексата, по этой схеме не реагирует.
Фолиевая кислота синтезируется бактериями с участием п -аминобензойной кислоты (обязательный фактор роста многих микроорганизмов). Близкий ей по структуре и по многим свойствам п -аминобензолсульфамид (стрептоцид, антиметаболит п -аминобензойной кислоты)
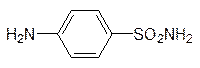
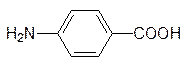
блокирует биосинтез фолата в бактериях, так как его сульфамидная группа не может вступать в реакцию ацилирования с глютаминовой кислотой.
Этим определяются бактериостатические свойства стрептоцида и таких сульфамидных препаратов, как сульфодиметоксин и др. Животные получают фолат в готовом виде (это витамин Вс), поэтому их клетки не имеют транспортной системы для п -аминобензойной кислоты, а следовательно, и для стрептоцида. В отличие от этого метотрексат транспортируется в клетки животных вместе с фолатом и связывается с соответствующим апоферментом настолько прочно, что даже без образования ковалентной связи ингибирование им фолатзависимых ферментов носит необратимый характер. В клетки бактерий фолат не поступает, он в них синтезируется, поэтому метотрексат не является бактерицидом. В то же время, более простые антиметаболиты фолата на основе диаминопиримидина используются в качестве антибактериальных препаратов:
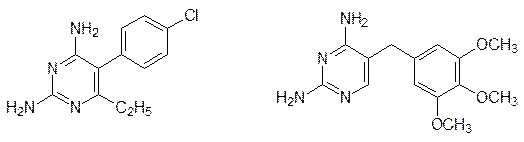
Хлоридин Триметоприм
Еще одни пример использования структурного подобия представлен противотуберкулезным средством – п -аминосалициловой кислотой (ПАСК), которая аналогична п -аминобензойной кислоте, но отличается от нее присутствием «лишней» гидроксильной группы:
 | и | 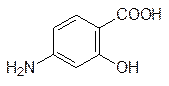 |
В этом случае вероятнее всего реализуется иной механизм биологической активности, отличный от антиметаболитного, основанного на блокировке активного центра фермента. Транспортная система в мембране микробактерий туберкулеза плохо различает эти два вещества, и ПАСК попадает в цитоплазму патогенов, где проявляются цитотоксические свойства этого вещества, обусловленные присутствием в его структуре токсофорной фенольной группы. В мембранах клеток легочной ткани и других поражаемых палочками Коха тканей организма транспортная система для п ‑аминобензойной кислоты отсутствует, а пассивная диффузия через мембраны протекает очень медленно, поэтому ПАСК мало токсична. Правда, эффективность этого противотуберкулезного средства очень низка и принимать ПАСК приходится дозами до десятков граммов в день.
Неконкуретное ингибирование имеет место в тех случаях, когда его эффективность зависит только от концентрации ингибитора и не зависит от концентрации субстрата. Это означает, что неконкуретные ингибиторы связываются белковой молекулой фермента не в активном центре, а в другом (от греч. allos – другой) месте, причем это может быть регуляторный центр аллостерического фермента или участвующий в перестройке структуры белка «гидрофобный карман».
С кинетической точки зрения при неконкуретном ингибировании возможно образование двух заблокированных комплексов по схеме:
 | или | 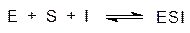 |
Поскольку место связывания неконкурентного ингибитора не совпадает с местом связывания субстрата, структуры неконкуретных ингибиторов чаще всего не имеют ничего общего со структурами субстратов, а их взаимодействие с ферментами носит обычно необратимый характер. При неконкуретном ингибировании снижение скорости реакции соответствует снижению концентрации катализатора, поэтому повышением концентрации субстрата компенсировать действие ингибитора не удается.
По типу второй реакции протекает и так называемое бесконкуретное ингибирование
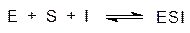 | , |
но в этом случае ингибитор вместе с субстратом занимает каталитический центр.
ГЛАВА 6. МЕТАБОЛИЗМ
Совокупность ферментативных реакций, протекающих в живых клетках, называется метаболизмом. Метаболические процессы решают четыре основных задачи:
· генерирование в клетках свободной химической энергии путем преобразования энергии солнечного света или превращения богатых энергией веществ;
· превращение веществ в строительные блоки, используемые клетками для синтеза макромолекул и других биогенных веществ;
· биосинтез белков, полисахаридов, нуклеиновых кислот и других клеточных элементов из этих строительных блоков;
· синтез новых веществ, разложение лишних веществ, поступающих в клетку, а также разложение выполнивших свою роль биомолекул.
Метаболические процессы сопровождаются выделением теплоты, поддерживающей оптимальный температурный режим для протекания биохимических превращений, хотя у теплокровных есть еще специальный механизм окислительного превращения субстратов, предназначенный только для регуляции температуры тела.
Таким образом, метаболические превращения включают обмен веществ и биоэнергетические процессы.
Высокая скорость и избирательность ферментативных реакций согласуются с тем, что метаболизм основан на высокоорганизованной и согласованной работе взаимосвязанных мультиферментных систем. Простые, единичные превращения веществ в биохимии редки. Чаще всего речь идет о линейных или циклических путях превращений, протекающих при согласованном катализе многими ферментами (мультиферментными системами), и дирижерами при этом являются регуляторные ферменты, называемые также аллостерическими ферментами (см. стр. 121):
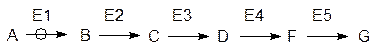
Здесь символом А обозначен субстрат регуляторного фермента, В, С, D, F и G – продукты последовательных превращений – метаболиты, Е1–Е5 – ферменты (Е1 – регуляторный).
Часто метаболические превращения организованы как циклические процессы, и они отличаются от этой схемы тем, что конечный и один из начальных продуктов в такой цепочке представляют собой одно и то же вещество, например:
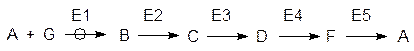
Метаболизм включает две основных составляющих – катаболизм и анаболизм. Катаболические превращения протекают с упрощением структур исходных молекул. Катаболизм – это основа биоэнергетики, так как превращение сложных молекул в более простые чаще всего сопровождается выигрышем в энергии. В живой природе эта энергия аккумулируется в определенных веществах, главным образом в аденозинтрифосфате (АТФ) и его аналоге гуанозинтрифосфате (ГТФ), а также в никотинамидадениндинуклеотиде (NADH) или никотинамидадениндинуклеотид фосфате в восстановленной форме (NADPH), которые образуются в ходе катаболических процессов. У аэробных организмов для биосинтеза АТФ может быть также использован энергетический выход реакции окисления NADH или NADPH. Богатые химической энергией вещества лежат в основе анаболических превращений, когда из простых веществ с затратой энергии получаются более сложные.
Метаболизм слагается из различных ферментативных реакций, но центральные пути превращений углеводов, аминокислот, жирных кислот и биогенных фосфатов немногочисленны и, что самое главное, едины для всего живого (рис. 6.1):
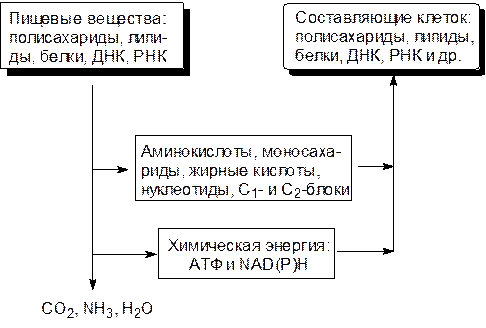
Левая нисходящая ветвь на этой схеме представлена катаболическими процессами, правая – анаболическими. Катаболические пути сходятся: из всего разнообразия вовлеченных в них веществ образуется сравнительно немного одинаковых молекул. Так, например, все разнообразие белков при ферментативном гидролизе сводится к двадцати белковым аминокислотам, тогда как катаболические превращения сахаров, жирных кислот и некоторых аминокислот приводят к образованию одного вещества – ацетил-кофермента А (СоАS–СОСН3).
Анаболические пути расходятся: небольшое число аминокислот, сахаров, жирных кислот, нуклеотидов, а также одно- и двухуглеродных блоков являются исходными продуктами для всего разнообразия структурных элементов живой природы.
Все ферментативные процессы обратимы, но, несмотря на это, пути синтеза и деградации биомолекул в многостадийных превращениях различаются на одном или на нескольких этапах. Вторичной причиной тому служат термодинамические ограничения. Так, например, для более или менее разумной скорости протекания реакций при полной обратимости в цепи превращений
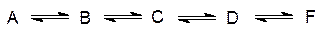
потребовались бы достаточно высокие значения стационарных концентраций метаболитов, а рост концентрации конечного продукта привел бы и к росту концентрации исходного продукта (аналогия с кладкой стены: если нет подвоза кирпичей, то Вы же не прекращаете работу, оставив часть кирпичей). Более существенна необходимость раздельной регуляции катаболических и анаболических процессов, поскольку иначе блокировка одного из этапов катаболического превращения привела бы к остановке и соответствующего анаболического процесса. Различие может состоять во включении обходных путей, иных промежуточных стадий, а также в появлении новых ферментов на одной или на нескольких стадиях прямых и обратных превращений. Важно также, что катаболические и анаболические пути должны быть разделены по месту их протекания (локализации), то есть разделены пространственно. Это необходимо для того, чтобы исключить холостые циклы. Так, например, в процессе катаболизма глюкозы с участием АТФ образуется 6‑фосфоглюкоза, а при глюконеогенезе (при биосинтезе глюкозы) это вещество гидролизуется, но АТФ при этом не образуется. При совмещении этих путей в одном месте происходило бы непроизводительное расходование АТФ – важнейшего участника биоэнергетических процессов. В качестве примера пространственного разделения можно привести окислительные превращения с выигрышем энергии, которые идут в клеточных органеллах митохондриях, тогда как восстановительные энергозатратные анаболические процессы образования тех же самых веществ локализованы в жидкой среде клетки – цитозоле.
Генерируемая в катаболических превращениях энергия представляет собой свободную энергию (или энергию Гиббса Δ G °), за счет которой система может совершать работу при постоянных температуре и давлении.
В пределах клетки температура мало различается, и энергия химических превращений реализуется через образование макроэргических соединений, главным из которых является аденозинтрифосфат (АТФ, АТР). АТФ содержит две ангидридные связи, гидролиз которых сопровождается выделением энергии, равной ~7,3 ккал/моль (30,5 кДж/моль):
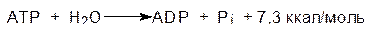

где ADP – аденозиндифосфат; AMP – аденозинмонофосфат; Pi и PРi –принятые в биохимии обозначения анионов фосфорной и пирофосфорной кислот (i – inorganic), в общем случае для фосфорной кислоты в клетке это смесь кислых фосфатов.
Энергетический выход гидролиза аденозинмонофосфата на аденозин и фосфат Δ G °¢) составляет 3,4 ккал/моль (14,2 кДж/моль), а макроэргическими являются связи, у которых Δ G °¢ превышает 30 кДж/моль. Вещества с пирофосфатными связями – важнейшие, но не единственные макроэргические фосфаты в биохимии. Кроме них можно назвать еще смешанные ангидриды карбоновых кислот и фосфорной кислоты (около –49 кДж/моль), гуанидинофосфаты (около –43 кДж/моль) и енолфосфаты (около –62 кДж/моль).
Заложенная в АТФ химическая энергия используется для:
· метаболических превращений (при этом молекулы-предшественники фосфорилируются аденозинтрифосфатом в присутствии соответствующих ферментов с образованием активных фосфатов, которые и включаются в обменные процессы);
· передвижения молекул;
· переноса веществ через клеточные мембраны против градиента концентраций;
· осуществления процессов, связанных с передачей наследственной (генетической) информации.
Легче всего роль пирофосфатной связи демонстрируется на реакциях конденсации. Предположим, что в клетке должна пройти эндотермическая реакция
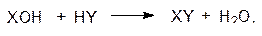
для которой свободная энергия Гиббса Δ G °¢ равна 12,5 кДж/моль. С участием АТФ (сопряженная реакция) эта схема приобретает следующий вид:


или в сумме:
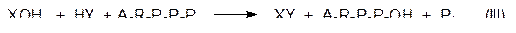
где А означает остаток аденина, R – остаток рибозы, Р – фосфатный фрагмент.
В суммарной схеме (III) на реакцию образования XY накладывается реакция гидролиза АТФ с образованием АДФ и фосфорной кислоты (Pi) с экзотермическим эффектом –30,5 кДж/моль. Тогда по свободной энергии в сумме получается экзотермический эффект: 12,5 – 30,5 = –18 кДж/моль.
Помимо АТФ важнейшим источником химической энергии является восстановительный потенциал, универсальным носителем которого в живой природе стали NADH и NADPH, образующиеся в результате переноса гидрид-иона (Н–) или двух электронов и одного протона на NAD+ или, соответственно, на NADP+, например:
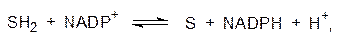
где SH2 представляет собой субстрат реакции дегидрирования. Химически этот процесс сопровождается переходом пиридиниевого фрагмента молекулы NAD+ или NADP+ в дигидропиридиновый путем присоединения гидрид-иона или протона и двух электронов, например:
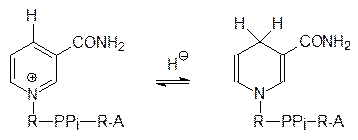
Восстановленные формы NADH и NADPH включаются в другие окислительно-восстановительные процессы, в том числе и в биосинтез АТФ, и снова превращаются в NAD+ и NADP+.
Химические свойства и окислительно-восстановительные потенциалы NADН и NADPН почти неразличимы (–0,32 В), но лишняя фосфатная группа в последнем делает его несовместимым с апоферментами для пары NAD+/NADH, что позволяет, например, разделять метаболические пути за счет участия этих двух коферментов (косубстратов).
Метаболические пути регулируются по трем механизмам. В соответствии с первым механизмом реализуется принцип обратной связи за счет участия в цепи превращений аллостерического (регуляторного) фермента, который практически всегда катализирует необратимую, лимитирующую скорость всего процесса стадию в цепи метаболических превращений. В роли положительных эффекторов аллостерических ферментов чаще всего выступают исходные продукты метаболических превращений или вещества из других метаболических реакций. В соответствии с этим, отрицательными эффекторами всегда являются конечные продукты метаболических превращений или также метаболиты из других реакций. Так, например, в процессах, связанных с образованием АТФ, положительными эффекторами являются АДФ и фосфат, а отрицательным сам АТФ. При этом надо понимать, что речь здесь идет отнюдь не о законе действующих масс, то есть скорость реакции повышается из-за увеличения активности катализатора в результате его взаимодействия с положительным эффектором.
По второму механизму регуляция метаболических превращений осуществляется гормонами. Эти вещества вырабатываются железами внутренней секреции (эндокринными железами). Выделяясь непосредственно в кровь, гормоны переносятся к другим клеткам и тормозят или стимулируют определенные виды метаболизма по различным механизмам.
Один из таких механизмов демонстрируется на адреналине – гормоне, который продуцируется мозговой (внутренней) частью надпочечников (отсюда англоязычное название адреналина – эпинефрин). Этот гормон вызывает широкий спектр биохимических и физиологических откликов, но здесь речь идет о мобилизации гликогена для покрытия энергетических потребностей организма. Гликоген представляет собой полисахарид, состоящий из соединенных 1,4‑a-гликозидными связями молекул a‑глюкопиранозы. Сама глюкоза не может присутствовать в клетках в значительных количествах из-за осмотических ограничений. Для обеспечения энергетических потребностей гликоген с участием фосфорной кислоты последовательно отщепляет молекулы фосфоглюкозы, которая далее подвергается катаболическому превращению с образованием АТФ.
В состоянии опасности по команде ЦНС клетки мозгового вещества надпочечников выбрасывают в кровь адреналин. Циркулирующий с кровью адреналин связывается с рецепторным белком на внешней стороне мембран клеток мышечной ткани и других клеток, что приводит к активации фермента аденилатциклазы (посредниками между адренорецетором и аденилатциклазой служат G-белки). Аденилатциклаза – это фермент, превращающий АТФ в циклический аденозинмонофосфат (цАМФ, сАМР). Этот внутриклеточный посредник («мессенджер») активирует другой фермент – протеинкиназу (Р); в неактивном виде она соединена с регуляторным белком (P–R). цАМФ связывается с этим регуляторным белком и освобождает активную протеинкиназу:
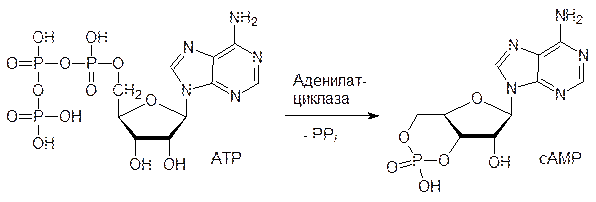

Протеинкиназа в свою очередь катализирует реакцию фосфорилирования фосфорилазы с участием АТФ, а фосфорилированная фосфорилаза в виде тетрамера уже катализирует реакцию гликогена с фосфорной кислотой, протекающую с образованием 1‑фосфоглюкозы, используемой клетками для получения АТФ. Далее представлена схема отщепления фосфорной кислотой (фосфоролиза) концевого глюкозидного фрагмента молекулы гликогена:
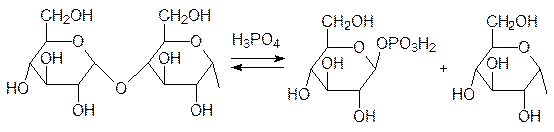
Более выгодно запасать энергию в виде жиров, которые в окислительных превращениях дают больше энергии, чем углеводы. К тому же возможности организма человека по депонированию гликогена ограничены. В жировой же ткани находится в 50 раз больше энергии, чем в гликогене. При избыточном поступлении в организм углеводов они через двухуглеродные продукты катаболических превращений переводятся в жирные кислоты, образующие с глицерином триэфиры – это и есть жиры, откладывающиеся в специальных клетках (адипоцитах). Однако обратного пути из жирных кислот в сахара не существует. При диете, основанной на ограничении энергетической ценности пищи, или при голодании начинают расходоваться не жиры, а белки, поскольку, например, ткани мозга покрывают свои энергетические потребности только за счет глюкозы и некоторых кетопроизводных («кетоновых тел»), которые образуются из многих белковых аминокислот. Запасные белки существуют только в семенах растений или, например, в яйцах птиц. Если в диете отсутствуют углеводы и мало белков, то организму для обеспечения потребности в аминокислотах, из которых может синтезироваться глюкоза (их называют глюкогенными), приходится расходовать мышечную ткань.
Третий механизм регуляции метаболизма основан на изменении концентрации ферментов в зависимости от потребности в обеспечиваемых ими превращениях. Это означает, что ферменты, для которых отсутствует субстрат, перестают синтезироваться рибосомами, но при росте потребности в этих ферментах снова активируется соответствующий генный участок ДНК (вообще-то и этот процесс основан на гормональной регуляции), снова образуется мРНК, и синтез фермента по этой матрице возобновляется. В качестве примера здесь можно привести изменение в балансе питания. При недостаточном поступлении углеводов с пищей интенсифицируется глюконеогенез – длинная цепь превращений образующихся из аминокислот трехуглеродных и четырехуглеродных кетокислот, которые завершаются образованием глюкозы. При нормальном балансе веществ в пище нет необходимости в этом процессе, но при недостатке глюкозы начинается биосинтез комплекса ферментов, отвечающих за глюконеогенез, и потребности организма в глюкозе начинают покрываться за счет образования ее из глюкогенных аминокислот, поступающих с пищей, или при недостатке их в пище – из гидролизующихся белков мышечной ткани.
 2020-10-10
2020-10-10 717
717








