Даже при хорошо сбалансированном питании от 15 до 10 % энергии организм человека получает из аминокислот. Это связано в основном с тем, что поступающие пищевые белки не соответствуют по аминокислотному составу синтезируемым в организме в разное время белкам, поэтому «лишние» аминокислоты включаются в катаболические превращения. Кроме того, в организме постоянно идет процесс обновления собственных белков. Так, например, многие ферменты имеют время полупревращения, равное нескольким часам, хотя, конечно, структурные белки более долговечны. Процесс сборки-разборки белков (а в него включается до нескольких сот граммов белков в день) не идеален, и часть образовавшихся при этом аминокислот также включается в катаболические превращения.
На начальной стадии катаболического превращения аминокислот при катализе трансаминазами (пиридоксальфосфатзависимые ферменты) образуются a-кетокислоты. В общем виде эта реакция представляется как обмен аминогруппами и кетогруппами между аминокислотами и кетоглутаровой кислотой:
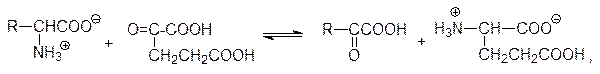
то есть аминокислота превращается в a-кетокислоту, а a-кетоглутаровая кислота превращается в глютаминовую кислоту.
Химизм этого процесса представляется следующим образом: сначала пиридоксальфосфат, связанный с белковой частью фермента (Е) взаимодействием его альдегидной группы с аминогруппой лизинового фрагмента белка, образует такую же связь с аминогруппой дезаминируемой аминокислоты. При этом ковалентная связь кофермента с белком разрывается и образуется комплекс белка с альдимином, образованным пиридоксальфосфатом и аминокислотой:
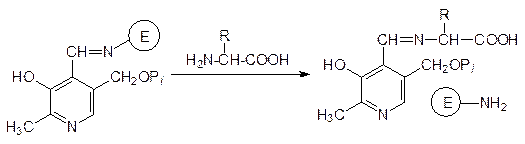
После этого альдемин изомеризуется с миграцией двойной связи и с образованием кетимина из пиридоксаминфосфата и a-кетокислоты:
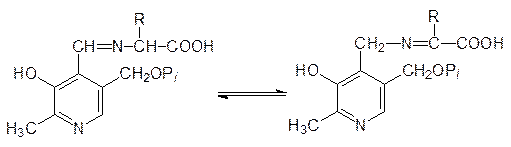
На следующей стадии превращения протекает гидролиз кетимина с образованием a-кетокислоты и пиридоксаминфосфата:

Для дезаминирования другой молекулы аминокислоты пиридоксаминфосфат должен снова превратиться в пиридоксальфосфат. Этот процесс сопровождается переносом аминогруппы с пиридоксаминфосфата на другую кетокислоту (чаще всего при этом a‑кетоглутаровая кислота превращается в глютаминовую кислоту):

Образовавшая в этой реакции глютаминовая кислота снова превращается в a‑кетоглутаровую по механизму дезаминирования, который будет рассмотрен ниже (стр. 153) при изучении биосинтеза мочевины.
Полученные в результате дезаминирования аминокислот кетокислоты разными путями превращаются в ацетилкофермент А или в молекулы глюкозы. Так, аланин превращается в пируват, глютаминовая кислота и глютамин превращаются в кетоглутарат, аспарагиновая кислота и аспарагин – в оксалоацетат (эти кетокислоты участвуют в цикле Кребса) и т.д.
При катаболическом превращения фенилаланина и тирозина дезаминирование должно быть дополнено превращениями ароматического остатка с образованием молекул, включающихся в цикл Кребса. Эта схема унифицирована для двух аминокислот и поэтому «лишний» фенилаланин сначала превращается в тирозин в результате окисления кислородом в присутствии фенилаланинмонооксигеназы:
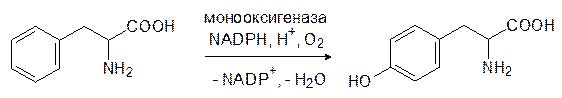
Затем тирозин по представленной выше схеме (см. стр. 148–149) дезаминируется соответствующей трансаминазой и превращается в гидроксифенилпировиноградную кислоту:

которая действием кислорода в присутствии соответствующей диоксигеназы превращается в гомогентизиновую кислоту:
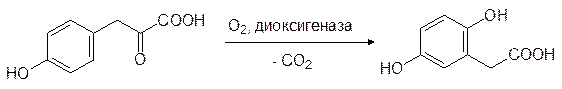
В результате этой реакции происходит окисление (гидроксилирование) ароматического цикла, окислительное декарбоксилирование боковой цепи и ее миграция в соседнее положение ароматического цикла.
На следующем этапе гомогентизат-1,2-диоксигеназа окисляет гомогентизиновую кислоту с раскрытием ароматического цикла (показана связь, раскрываемая молекулой кислорода):

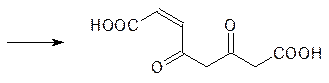
Образовавшаяся малеилацетоуксусная кислота ацилирует кофермент А с участием АТФ и при катализе тиолазой последовательно взаимодействует с коферментом А с разрывом С–С-связей по b-дикарбонильным участкам, расщепляясь на малеилкофермент А и две молекулы ацетил-кофермента А, включающиеся в цикл Кребса (малеилкофермент А для этого гидролизуется и изомеризуется в фумаровую кислоту).
Этот нормальный метаболизм фенилаланина может быть нарушен из-за дефектов генов, кодирующих участвующие в превращении ферменты. При пониженной активности фенилаланинмонооксигеназы избыток поступающего с пищей фенилаланина (а это одна из незаменимых аминокислот) превращается в фенилпировиноградную кислоту. Она выводится из организма через почки (фенилкетонурия), но часть ее реагирует с некоторыми важными биомолекулами нервной ткани (такие реакции, протекающие без участия ферментов, называют иногда параметаболическими). Эти превращения приводят к повреждению клеток центральной нервной системы.
Наследственная болезнь фенилкетонурия, приводящая в детском возрасте к слабоумию, должна быть диагностирована на самом раннем этапе развития новорожденного. Среди белокожего населения США ее частота составляет около одного случая на двадцать тысяч (среди афроамериканцев болезнь встречается реже). Это означает, например, что в США рождается в год около 3000 детей с фенилкетонурией. Если с первых дней жизни ребенка перевести его на специальную диету с пониженным содержанием фенилаланина, то развитие будет нормальным. Поэтому всем новорожденным надо сразу после рождения класть в пеленки индикаторную бумагу, реагирующую на бензилкетоны. В возрасте 12–14 лет можно уже переходить на обычную диету, но если женщина с фенилкетонурией собирается стать матерью, то ей снова надо выдерживать специальную диету еще до зачатия ребенка.
При пониженной активности гомогентизиндиоксигеназы непревращенная гомогентизиновая кислота выводится через почки и, окисляясь на воздухе, окрашивает мочу в черный цвет, однако, особых последствий для организма при этом не наблюдается. Гомогентизиновая кислота и в норме является исходным продуктом для образования меланина – вещества, окрашивающего кожу при загаре и волосы.
При рассмотрении механизма дезаминирования аминокислот пиридоксальфосфатзависимыми трансаминазами говорилось о том, что для регенерации пиридоксальфосфата из пиридоксаминфосфата живая природа использует кетоглутаровую кислоту – один из метаболитов цикла Кребса. Понятно, что образующаяся при этом глютаминовая кислота должна быть снова превращена в кетоглутарат. Для этого предназначена дегидрогеназа, осуществляющая реакцию:
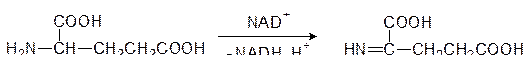
L -Глютаматдегидрогеназа – это регуляторный фермент с молекулярной массой около 300 кДа, состоящий из шести идентичных субъединиц. Его активность возрастает в присутствии аденозиндифосфата, а отрицательным эффектором является ГТФ, образующийся в цикле Кребса. Иминопроизводное кетоглутаровой кислоты гидролизуется водой с образованием кетоглутаровой кислоты и аммиака:
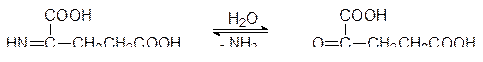
Обратный путь превращения кетоглутарата в глютамат также существует, но на стадии восстановления иминопроизводного участвует не L -глютаматдегидрогеназа, а другой NADP+-зависящий фермент.
Аммиак образует в водной среде сильное основание, и поэтому он токсичен для всего живого. Буферные системы жидких сред организма справляются с небольшими концентрациями аммиака, но, тем не менее, он как можно скорее должен быть переведен в нетоксичное производное. Один из путей детоксикации аммиака представлен превращением пирувата в аланин по схеме, аналогичной обратному процессу превращения глютаминовой кислоты в кетоглутаровую. По другому пути аммиак ацилируется глютаминовой кислотой с образованием глютамина:
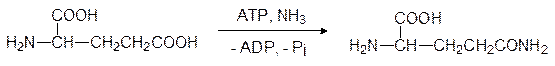
Этот путь играет важную роль в детоксикации аммиака в ЦНС, где глютаминовая кислота содержится в большом количестве, участвуя в передаче нервных импульсов. Аланин снова превращается в пируват с участием трансаминаз, а глютамин гидролизуется и снова превращается в глютаминовую кислоту и аммиак. В организме теплокровных этот процесс протекает в клетках печени, но другие виды живого используют иные пути. Проще всего проблему вывода аммиака решают водные животные: они просто выделяют его в воду. В жабрах рыб, личинок амфибий находится фермент глютаминаза, и образовавшийся в результате гидролиза глютамина аммиак просто диффундирует из крови в омывающую жабры воду (рыба тухнет с головы).
Для животных такой путь выведения аммиака не годится. Свободный аммиак не может поступать в мочу, так как для поддержания допустимой для биологических сред концентрации аммиака потребуется слишком много воды. Эта проблема не может быть решена и за счет образования нейтральных солей аммония, так как органические кислоты на это тратить слишком расточительно, а потеря неорганических анионов нарушит водно-солевой баланс организма. Существует также возможность образования бикарбоната аммония, и не исключено, что на ранних этапах эволюции этот вариант использовался живой природой, но все же бикарбонат аммония слишком нестоек и его растворы имеют сильно щелочную реакцию. Поэтому в процессе эволюции был выработан механизм выведения аммиака в виде нейтрального амида угольной кислоты – мочевины. Правда, и для выведения мочевины надо много воды, поэтому, например, птицы (для них важен вес) и рептилии, живущие часто в зонах с недостатком влаги, выработали иной механизм. Они выделяют избыточный аммиак в виде нерастворимой в воде мочевой кислоты
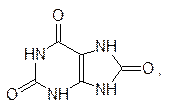
механизм биосинтеза которой здесь не рассматривается.
Оказалось, что мочевина образуется в циклическом процессе, в раскрытии механизма которого активное участие также принимал Кребс. В ходе исследования биохимических процессов, протекающих в тканях печени, было установлено, что в присутствии трех аминокислот: орнитина, цитруллина и аргинина


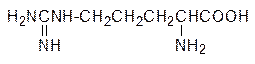
резко возрастает скорость образования мочевины. До этого было известно, что аргинин гидролизуется водой с образованием мочевины и небелковой аминокислоты орнитина, и можно было предположить, что эти аминокислоты участвуют в образовании мочевины, а связующим между ними служит цитруллин.
Позже было показано, что аргинин действительно образуется из орнитина через цитруллин и может гидролизоваться далее в присутствии аргиназы по реакции:
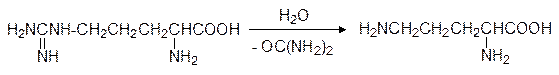
В митохондриях аммиак и диоксид углерода (из цикла Кребса) с участием двух молекул АТФ в присутствии фермента карбамоилфосфатсинтетазы I образуют смешанный ангидрид карбаминовой и фосфорной кислот – карбамоилфосфат:

Это соединение ацилирует орнитин по концевой аминогруппе (уходящей группой является фосфатный остаток) с образованием цитруллина:
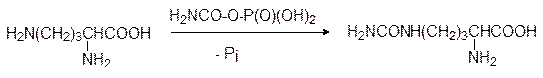
Далее цитруллин с участием АТФ реагирует с аспарагиновой кислотой с образованием аргининосукцината. Фермент, катализирующий это превращение, называется аргининосукцинатсинтетазой; АТФ при этом распадается на АМФ и пирофосфат, гидролизующийся до фосфата:
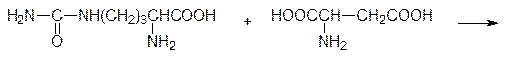
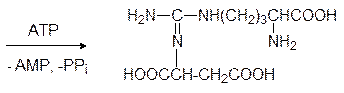
Затем аргининосукцинатлиаза расщепляет этот промежуточный продукт на аргинин и фумарат:
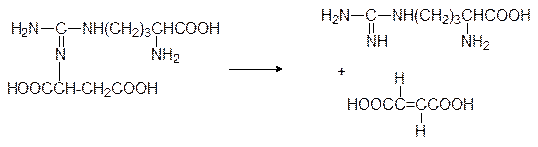
Фумарат встраивается в цикл Кребса и через малат и оксалоацетат с участием трансаминаз снова может превратиться в аспарагиновую кислоту. Синтез аргинина един для всего живого, но аргиназа присутствует только в клетках печени животных, выделяющих аммиак в виде мочевины (их называют уротелическими, в отличие от урикотелических, выделяющих аммиак в виде мочевой кислоты).
В результате такого циклического процесса (из аргинина образуется орнитин, с которого начиналась представленная выше цепь превращений) из организма выводятся два конечных продукта катаболических превращений – аммиак и бикарбонат (из СО2). Этот процесс участвует в регуляции рН крови, значение которого определяется содержанием бикарбоната. Энергетическая стоимость детоксикации аммиака достаточно высока: на один моль мочевины расходуется четыре эквивалента АТФ: два моля АТФ идут на образование карбамоилфосфата и один моль АТФ используется для синтеза аргининосукцината, но в этом случае аденозинтрифосфат разлагается на пирофосфат и аденозинмонофосфат, для превращения которого в АТФ нужно провести двойное фосфорилирование. Поэтому аминокислоты очень невыгодны в качестве источника энергии: их катаболическое превращение включает образование токсичного аммиака, на связывание которого в мочевину расходуется до 15% всего получаемого из аминокислот АТФ, кроме того, повышается нагрузка на почки.
В организме жвачных животных и верблюдов образовавшаяся в результате катаболических превращений аминокислот мочевина циркулирует в крови, и путем диффузии через ткани и стенки кровеносных сосудов она практически полностью переходит в отделы желудка, в которых живут бактерии, перерабатывающие целлюлозу и использующие мочевину в качестве источника аммиака для синтеза аминокислот.
 2020-10-10
2020-10-10 337
337








