Суммарный процесс последовательного катаболического превращения одного моля глюкозы в ходе гликолиза, окислительного декарбоксилирования пирувата и в цикле Кребса приводит к образованию 10 моль NADH (NADРH), 2 моль FADH2, 2 моль АТФ и 2 моль ГТФ. Аэробная клетка может использовать энергию, выделяющуюся при окислении восстановительного потенциала NADH (NADРH), для образования максимального количества АТФ. В простейшем виде эта реакция записывается уравнением:
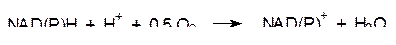
Энергетический эффект этой реакции примерно соответствует окислению водорода кислородом (220 кДж/моль). Эта энергия должна оптимальным образом использоваться для образования АТФ, на биосинтез которого из АДФ и фосфата затрачивается 14 ккал/моль (более 60 кДж/моль). Если учесть, что за сутки организм человека потребляет 2800 ккал/моль, то это соответствует образованию примерно 200 моль или 100 кг АТФ, хотя в организме его стационарное содержание составляет около 50 г. Эти цифры показывают с какой эффективностью работает механизм воспроизводства расходуемого АТФ, причем потребность в нем меняется в зависимости от рода деятельности, в каждый отдельный момент (активная работа, отдых, сон и т.д.).
Еще на ранней стадии биохимических исследований было установлено, что энергетическими «фабриками» аэробных эукариотических клеток являются митохондрии, а у прокариот синтез АТФ идет в клеточных мембранах. Митохондрии представляют собой органеллы размером примерно 0,5´1,5 мкм красновато-коричневого цвета (основной цвет пигментов, входящих в состав мембран), их число в клетках животных колеблется в пределах от нескольких сотен до нескольких тысяч
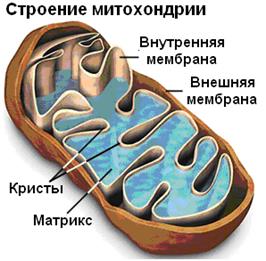
Строение митохондрий из разных организмов единообразно; они окружены двойной мембраной (рис. 8.1). Внешняя гладкая мембрана содержит транспортные белки и ферменты, отвечающие за превращения аминогрупп (моноаминоксидазы), а также ферменты, участвующие в обмене жирных кислот. Внутренняя мембрана митохондрий для увеличения ее поверхности образует множество впячиваний, называемых кристами. Итак, содержимое митохондрии разделено на два объема: межмембранное и внутреннее пространство (матрикс), отделенное от межмембранного пространства внутренней мембраной. Митохондрии делятся, причем они содержат свою собственную нитевидную ДНК и набор РНК, что позволяет сделать предположение о том, что их присутствие в клетке представляет собой нечто вроде симбиоза: они могли образоваться в результате эндоцитоза аэробных прокариот анаэробными эукариотами и сохраниться в них, получая питательные вещества и снабжая приютившую их клетку аденозинтрифосфатом. Все митохондрии в клетках организмов, размножающихся половым путем, получены от материнской клетки. Это позволяет использовать ДНК митохондрий для установления родства.
Основные катаболические процессы локализованы в матриксе митохондрий. Сюда соответствующими транспортными системами переносятся субстраты для цикла Кребса и катаболического превращения жирных кислот (пируват, глутамат, аспартат, малат, 2‑кетоглутарат, цитрат, жирные кислоты), а также АДФ и фосфат, из которых образуется АТФ. Именно в матриксе митохондрий протекают конечные стадии катаболического превращения углеводов и жирных кислот, сопровождающиеся образованием восстановительного потенциала.
Что же мы знаем о механизме образования АТФ в митохондриях? Субстратный путь образования АТФ, который реализуется живой природой при анаэробном катаболическом превращении глюкозы (перенос макроэргической фосфатной связи на АДФ с 1,3-дифосфоглицерата и с фосфоенолпирувата), очевидно, не может быть достаточно эффективно использован при окислении восстановительного потенциала, заложенного в NADH (NADРH) и в FADH2. Поэтому эволюция клеток в кислородсодержащей среде пошла по принципиально иному пути, использующему для синтеза АТФ электрохимический потенциал и градиент концентраций протонов с коэффициентом полезного действия, достигающим 60%. Этот процесс называют окислительным фосфорилированием.
Реакция окисления NADH может быть представлена двумя полуреакциями. Сначала NADH отдает пару электронов по схеме:
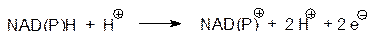
В стандартных биохимических условиях окислительно-восстановительный потенциал Е ° этого процесса равен –0,320 В. Затем пара электронов переносится на кислород:

Для этой полуреакции Е ° = +0,816 В. Суммарная реакция окисления NADH кислородом характеризуется значением Е ° 1,136 В, что соответствует D G °¢ около 220 кДж/моль, тогда как на образование одного моля АТФ затрачивается более 60 кДж.
Электроны, отданные восстановленными формами никотинамидадениндинуклеотида (NADH) или его фосфата (NADPH) и флавопротеинов, переносятся во внутренней мембране митохондрий в результате окислительно-восстановительных превращений молекул убихинона и атомов железа в железосерных белках и в гемовых структурах в составе цитохромов (обычно их называют пигментами электронпереносящей цепи). Движение электронов по компонентам электронпереносящей цепи сопровождается снижением восстановительного потенциала каждого принявшего электрон участника процесса, что в свою очередь сопровождается выделением энергии, которая может быть использована для синтеза АТФ. При этом исключается образование макроэргических соединений из компонент электронпереносящей цепи и фосфатов, так как при нарушении целостности внутренней мембраны митохондрии она продолжает окислять NADH (NADРH), но перестает генерировать АТФ. Есть даже митохондрии с пористой внутренней мембраной (митохондрии бурого жира), которые предназначены исключительно для генерирования теплоты. Было установлено, что в межмембранном пространстве устанавливается кислая среда, и есть много соединений, которые хорошо растворяются в липидах мембран как в виде аниона, так и в протонированном виде. Оказалось, что в их присутствии даже сплошная мембрана перестает синтезировать АТФ. Такие вещества называют разобщителями окислительного фосфорилирования. Классический пример – 2,4-динитрофенол. Некоторое время это соединение даже использовали в качестве медикаментозного средства для снижения веса. Его присутствие в организме приводит к непроизводительному расходованию пищевых веществ, выражающемуся в повышении температуры тела.
Антибиотик валиномицин, структура которого напоминает баранку, составленную из повторяющихся фрагментов валина, гидроксиизовалериановой кислоты и молочной кислоты, переносит через мембраны ионы калия, снижая тем самым электрохимический мембранный потенциал. Это вещество послужило отправной точкой для получения циклических краун-эфиров, используемых в качестве катализаторов межфазного переноса. Итак, упомянутые выше косвенные данные говорят о том, что движущей силой в образовании АТФ является разность концентраций протонов по разные стороны внутренней мембраны митохондрий.
Митохондриальная цепь переноса электронов включает:
· никотинамидадениндинуклеотидный акцептор электронов и флавопротеин с флавинмононуклеотидом;
· белки с железосерными кластерами, в которых атомы железа (два и более) связаны с сульфгидрильными группами цистеиновых фрагментов белка с участием неорганических сульфидных структурных элементов;
· убихинон, связанный с мембраной исключительно гидрофобным взаимодействием олигоизопреноидного остатка этого вещества с липидными компонентами мембран;
· цитохромы (cyt b, cyt c1, cyt c, cyt a, cyt a3) – белки с различными гемами.
Все компоненты цепи переноса электронов, кроме цитохрома с (этот низкомолекулярный белок легко отмывается солевыми растворами), интегрированы в мембрану. В старых учебниках по биохимии приводится такая последовательность движения электронов по электронпереносящей цепи:
NADРH ® FMN ® убихинон ® cyt b ® cyt c1 ® cyt c ® cyt aa3 ® O2
Железосерные белки выполняют роль посредников (накопителей электронов) при контакте FMN с убихиноном и цитохрома b с цитохромом с1. В железосерных белках и в цитохромах перенос электронов осуществляется путем окисления и восстановления атомов железа Fe2+ и Fe3+.
Убихинон (кофермент Q) переносит электроны путем превращения его в гидрохинон:

Понятно, что с помощью убихинона идет не только транспорт электронов, но и перенос протонов, которые при образовании аниона гидрохиноновой формы могут быть приняты в матриксе, а при окислении с образованием хиноновой формы они могут быть отданы уже в межмембранное пространство. У гидрохинонов есть три степени окисления: сами гидрохиноны, свободнорадикальные семихиноны (–е–) и хиноны (–2е–), все они включены в систему транспорта протонов против градиента концентрации.
Перенос протонов возможен также в результате окислительно-восстановительных превращений гемов, так как в максимальной степени окисления атом железа связан с одним анионным остатком, а при переходе железа в двухвалентное состояние этот анион может быть протонирован.
Очень важна роль цитохромов а и а3, связанных в прочный комплекс. Эти переносчики электронов имеют две гемовых компоненты и два иона меди, которые также участвуют в переносе электронов за счет перехода

Важность согласованной работы комплекса цитохромов а и а3 состоит в том, что они должны одновременно перенести на молекулу кислорода четыре электрона. Любой сбой в этой системе вызовет образование активного окислителя – супероксида (один электрон), пероксида (два электрона) или гидроксильного радикала (три электрона).
В соответствии с устаревшими представлениями о работе системы окислительного фосфорилирования предполагалось, что перенос электронов от NADРH сопровождается переносом из матрикса в межмембранное пространство шести протонов, в результате чего в нем устанавливается кислая среда с рН около 4,0. Возникший градиент концентраций протонов при обратной диффузии их через АТФ‑синтетазный комплекс белков приводит к фосфорилированию АДФ активным фосфатом (в схеме А и R означают, соответственно, адениновый и рибозидный остатки):


Сегодня считается, что интегрированные в мембрану пигменты электронпереносящей цепи скомпонованы в четыре комплекса. В состав первого входит NAD, второй включает FAD, третий –цитохромы b и с1, четвертый – цитохромы а и а3. Цитохром с – это периферический гемопротеин с небольшой молекулярной массой (в его составе кроме гема около ста аминокислот), он растворим в воде и легко перемещается по внешней стороне внутренней мембраны, осуществляя связь между разными комплексами электронпереносящей цепи.
Установлено, что для синтеза одной молекулы АТФ из межмебранного пространства в матрикс входят три протона. Но для этого из матрикса должны выйти четыре протона, так как один протон теряется при обмене молекулы АТФ, образовавшейся в матриксе, на поступающие из межмембранного пространства АДФ и фосфат. Работа электронпереносящей цепи, сопровождающая окислением восстановительного потенциала одной молекулы NADH (NADРH), завершается выходом из матрикса в межмембранное пространство десяти протонов. Окисление молекулы FADH2 с более низким восстановительным потенциалом сопровождается выходом шести протонов. Из них, очевидно, два протона – это результат образования в матриксе недиссоциирующей молекулы воды из молекулы кислорода (связывание двух протонов в матриксе эквивалентно появлению двух протонов в межмембранном пространстве), а еще восемь (или четыре от FADH2) – это не установленная во всех деталях работа убихинона и других пигментов электронпереносящей цепи. В соответствии с этим окисление 1 моль NADH (NADРH) завершается образованием 2,5 моль АТФ, а окисление одного моля FADH2 дает 1,5 моль АТФ.
Внутренняя (обращенная к матриксу) поверхность крист внутренней мембраны плотно покрыта сферическими белковыми структурами, которые прикреплены к погруженному в мембрану комплексу нескольких интегрированных белков. Вместе они образуют ферментную систему АТФ-синтетазы (иногда ее называют также АТФ‑синтазой), осуществляющей биосинтез АТФ из АДФ и фосфата. В ходе эволюции этот фермент изменялся очень незначительно. Во всяком случае различия между АТФ‑синтетазами прокариот, одноклеточных организмов, хлоропластов в растениях, митохондрий в клетках растений и животных очень незначительны. Принцип функционирования АТФ-синтетаз лежит также в основе биохимических систем, приводящих в движение жгутики однолеточных и сперматозоидов.
Долгое время не удавалось установить механизм работы АТФ-синтетазы. Было известно, что она состоит из двух принципиально различных комплексов белков. Один из них с обозначением Fo (он блокируется олигомицином) интегрирован в мембрану, другой (F1) связан с первым, но выступает из мембраны. Их можно разделить, поместив мембрану с АТФ-синтетазой в солевой раствор, отделяющий растворимую в воде компоненту F1 от мембраны. Современные достижения в исследовании пространственного строения белков позволили получить достаточно точное представление о функционировании этой системы, похожей на электромотор из белковых молекул (рис. 8.2).
Интегрированная в мембрану компонента Fo состоит из трех различных типов фиксированных в липидах мембраны гидрофобных белковых субъединиц (а, b и c). Субъединица а является частью системы, преобразующей энергию движущихся по градиенту концентраций протонов во вращательное движение. Образованная двумя пептидными цепями субъединица b связывает с мембраной компоненту F1, лишая ее возможности вращаться вместе с выполняющей роль ротора субъединицей γ, входящей в состав компоненты F1. Субъединицы с расположены по кругу. У бактерии Escherichia Coli он образован двенадцатью пептидными цепями, каждая из которых сложена вдвое с перегибом примерно в середине цепи. Каждая пептидная цепь субъединицы с имеет активный центр, вызывающий перемещение субъединицы с по кругу при прохождении протонов из межмембранного пространства в матрикс митохондрии на границе контакта субъединиц а и с.
Растворимая в воде компонента F1 находится на обращенной к матриксу стороне внутренней мембраны митохондрии. В ее состав входят пять типов субъединиц – α, β, γ, δ и ε. Три пары белков, состоящих из субъединиц α и β, образуют каталитические системы, на которых идет синтез АТФ из АДФ и фосфата. Связанная с субъединицей с вращающаяся ось АТФ-синтазы обозначается как γ. Ее вращение, вызванное движением протонов в компоненте Fо, вызывает структурные перестройки в субъединицах a и b. Субъединица δ соединяет комплекс трех пар белков a и b с интегрированной в мембрану субъединицей b, и не дает им вращаться вместе с осью γ. Предполагается, что субъединица ε связывает с осью γ кольцо из субъединиц с.

Активные центры, отвечающие за биосинтез АТФ, расположены между белками a и b. Структурной перестройкой образующих активный центр аминокислотных фрагментов этих пар белков управляет ротор g. В одном фиксированном положении активный центр, образованный первой парой белков a и b, открыт, и в него входят и соответственно ориентируются молекулы АДФ и фосфорной кислоты. В другой паре a и b создаются условия для фосфорилирования АДФ фосфорной кислотой и образуется АТФ (по приведенной на стр. 164 реакции активации фосфорной кислоты с образованием фосфорцентрированного катиона). В третьей паре активный центр раскрыт и образовавшаяся молекула АТФ покидает его. В результате диффузии трех протонов через субъединицу Fо ротор g и связанный с ним белок e поворачиваются на 120° и вызывают структурную перестройку в создающих активный центр белках a и b, в результате которой в первой паре создаются условия для синтеза АТФ, вторая пара открывает активный центр и освобождается от образовавшей молекулы АТФ, а третья пара принимает АДФ и фосфат. В следующем повороте на 120° роли снова поменяются в этом порядке. Поскольку в состав комплекса F1 входят три пары катализирующих биосинтез АТФ белков a и b, один полный оборот ротора g с белком e в самом благоприятном случае приводит к образованию трех молекул АТФ. Работа этой системы носит обратимый характер. В избытке АТФ ротор вращается, вызывая транспорт протонов против градиента концентраций (АТФ при этом гидролизуется на АДФ и фосфат). Этот процесс используется некоторыми бактериями для поддержания водно-солевого баланса.
В АТФ-синтетазе природой реализован не имеющий аналогов в органической химии механизм использования энтропийного фактора для образования источника свободной химической энергии.
Для раскрытия деталей этого механизма было использовано много оригинальных методик, включая, например, присоединение к выступающему из F1 субъединицы концу ротора g фибриллярного белка актина с молекулами светящегося в УФ-свете люминофора, присоединенного к функциональным группам на поверхности этого фибриллярного белка. С помощью микроскопа можно наблюдать его вращение и даже определять скорость вращения. Весь этот комплекс исследований был отмечен Нобелевской премией 1997 г. (П.Д. Бойер и Дж. Э. Уокер).
ГЛАВА 9. ФОТОСИНТЕЗ
Фотосинтез – это основной анаболический процесс, основанный на ассимиляции диоксида углерода с образованием углеводов, протекающий на свету во всех содержащих хлорофилл клетках. В катаболических окислительных превращениях и при горении углеводов образуются диоксид углерода и вода, выделяется энергия и потребляется кислород. Из этого следует, что обратный процесс может протекать только с затратой энергии (ее то и поставляет поглощаемый хлорофиллами свет) и с участием восстановительного потенциала. Поскольку в природе водород находится в виде протонов, восстановление диоксида углерода должно сопровождаться переносом электронов от какого-либо донора (ХΘ):
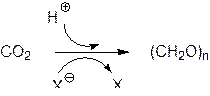
Интенсивность фотосинтеза зависит от температуры и поэтому все протекающие при этом реакции не могут быть чисто фотохимическими. Это подтверждается и тем, что ассимиляция диоксида углерода некоторое время продолжается и после переноса растения в темноту. Понятно также, что энергия света должна быть трансформирована в обычный для живых клеток источник химической энергии, которым может быть только АТФ. Поскольку окислительно-восстановительный потенциал системы глюкоза–кислород/вода–диоксид углерода равен примерно –0,4 В, участвующий в превращении СО2 → углеводы восстановитель должен иметь более сильный восстановительный потенциал. В этой роли выступает NADPH с восстановительным потенциалом, равным около –0,45 В. Эти общие рассуждения приводят к следующим выводам:
1. Превращение диоксида углерода в углеводы требует восстановительного потенциала и АТФ.
2. Свет нужен только для образования в клетке аденозинтрифосфата и NADPH.
3. При наличии в клетке АТФ и NADPH превращение диоксида углерода в углеводы может идти и без света (правда это не совсем верно, так как некоторые участвующие в ассимиляции ферменты активируются светом).
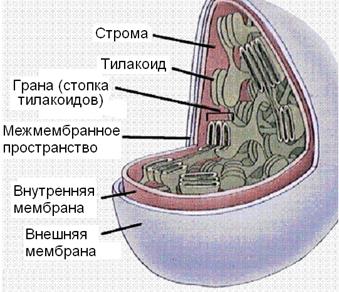
Организмы, использующие в качестве источника энергии свет, очень разнообразны, а масштабы фотосинтеза можно проиллюстрировать тем, что весь кислород атмосферы Земли имеет биогенное происхождение. В настоящее время около половины всего кислорода поступает из воды в результате жизнедеятельности водорослей и фитопланктона. В растительных клетках фотосинтез протекает в органеллах, которые называются хлоропластами (рис. 9.1). Во внутренней среде (строме) хлоропластов, отделенной от цитозоля двойной мембраной, находятся плоские тилакоиды, стопки из которых образуют граны, все тилакоиды соединены протоками.
В мембране тилакоидов содержатся ферменты, транспортные белки и электронпереносящие пигменты. Одним из ферментов в мембране тилакоидов является АТФ-синтетаза, она аналогична АТФ-синтетазе митохондрий, работа которой представлена на стр. 165–168. Фиксация диоксида углерода идет в строме с участием соответствующих ферментов. Имеется определенное подобие хлоропластов и митохондрий, но набор транслоказ и ферментов в хлоропластах значительно беднее, поскольку в растениях основные катаболические превращения также протекают в митохондриях.
Для поглощения энергии света в фотосинтезирующих клетках содержатся хлорофиллы – магнийпорфирины зеленого цвета:
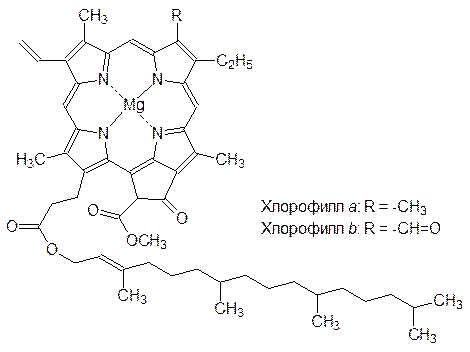
В число вспомогательных пигментов входят каротиноиды, защищающие молекулы хлорофиллов от повреждения активированным кислородом:

b-Каротин
Плоская металлопорфириновая структура хлорофилла фиксирована и определенным образом ориентирована в мембране тилакоида липофильным фрагментом сесквитерпенового спирта фитола, связанного эфирной связью с карбоксильной группой.
Циклическая система сопряженных двойных связей позволяет молекулам хлорофиллов поглощать в видимой области спектра широкие полосы с длинами волн около 450 нм (синий цвет) и около 650–700 нм (красный). Поглощение света сопровождается переходом электронов на орбитали с более высокой энергией. Так, поглощение «красного» фотона соответствует переходу электрона на первый энергетический уровень, «синего» – на второй. При этом составляющие пару электроны находятся в синглетных состояниях S 0, S 1 и S 2 (нулевой, первый и второй уровни), сохраняя антипараллельность спинов.
В молекулах с большим числом сопряженных двойных связей p‑электроны делокализованы, и для них становится возможным нахождение на нескольких подуровнях с энергиями выше и ниже основного p-p*-перехода изолированной двойной связи. На каждом из возбужденных состояний возможен безизлучательный переход возбужденного электрона (экситона) на более низкие подуровни с потерей энергии в виде теплоты при соударениях с другими молекулами. Этот процесс называется колебательной релаксацией. Возможен также безизлучательный переход электрона с орбитали S 2 на орбиталь S 1 в результате внутренней конверсии, если у подуровня с низкой энергией орбитали S 2 есть энергетический (частотный) эквивалент на одном из высоких подуровней орбитали S 1. Возврат на нулевой уровень протекает с излучением кванта света (флуоресценция) через несколько нано- или даже микросекунд после его поглощения.
При спонтанных обращениях спинов возбужденных электронов возвращение на нулевой уровень становится невозможным из-за того, что оба электрона пары получают параллельные спины. Такие возбужденные состояния, называемые триплетными (Т 1, Т 2), могут обмениваться электронами с молекулой кислорода, оба атома которой находятся в триплетном состоянии, и тогда образуется синглетный кислород, который обладает повышенной реакционной способностью по отношению к органическим веществам. Для нейтрализации (гашения) триплетного состояния хлорофилла и синглетного состояния кислорода в состав пигментов мембран тилакоидов входят каротиноиды, сопряженные двойные связи которых образуют электроннопе облако, задерживающее электрон с обращенным спином в неактивном состоянии. Излучательный возврат возбужденного триплетного состояния хлорофилла в невозбужденное синглетное возможен только после повторного обращения спина экситона. Это обычно растянуто во времени, и такое свечение называют фосфоресценцией. Независимо от длины волны поглощаемого света хлорофилл флуоресцирует и фосфоресцирует только в красном свете.
Цвет листа растения определяется соотношением пигментов в мембранах тилакоидов. Он может меняться от сине-зеленого у ели до темнобурого у некоторых декоративных растений и водорослей, но зеленые хлорофиллы обязательны для всех фотосинтезирующих биохимических систем. Все пигментные молекулы фотосистем поглощают свет и могут обмениваться экситонами, но на группу из примерно 200 молекул хлорофилла и 50 молекул каротиноидов есть одна пара молекул хлорофилла, связанных в комплекс с белком. Этот хлорофилл лежит в начале электронпереносящей цепи пигментов, превращающих световую энергию в химическую. В отличие от интегрированных в мембрану молекул хлорофилла, называемых антенными, комплекс хлорофилла и белка называют фотохимическим реакционным центром,или фотореакционным центром.
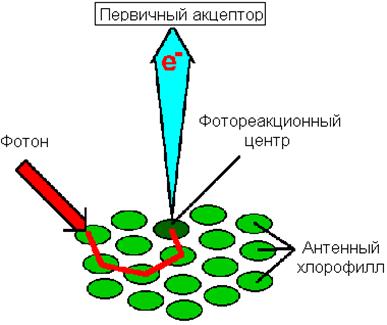
Передача экситона от одной молекулы к другой происходит в области перекрывания электронных облаков молекул: экситон переходит в электронное облако другой молекулы, а его место занимает S 0-электрон этой молекулы. Возбужденные электроны передаются от одной молекулы антенного хлорофилла к другой до тех пор, пока не оказываются в молекуле хлорофилла фотореакционного центра (рис. 9.2). Отсюда начинается их путь по пигментам мембраны тилакоидов для совершения работы по синтезу АТФ и для превращения NADP+ в NADPH. Тилакоидные мембраны высших растений содержат фотосистемы двух типов со своим набором антенных молекул и фотохимическими реакционными центрами. Фотосистема I (ФС I) поглощает свет в более длинноволновой области (около 700 нм), и при облучении изолированных хлоропластов монохроматическим светом с этой длиной волны генерируется восстановительный потенциал при невысокой скорости образования кислорода и биосинтеза АТФ. Основная полоса поглощения хлорофиллов фотосистемы II (ФС II) лежит в области 680 нм, и облучение хлоропластов только таким светом приводит к усилению синтеза АТФ с выделением кислорода. Существуют также микроорганизмы, в клетках которых фотосинтез не сопровождается генерированием кислорода. Их мембраны содержат только компоненты фотосистемы I.
Фотосинтезирующие микроорганизмы, обитающие в восстановительных средах, передают электроны возбужденного состояния хлорофилла на NADP+, а образовавшийся дефицит электронов восполняет донор, принимающий их от субстратов восстановителей (органические вещества, сероводород или др.). Однако подавляющее большинство растений и использующих энергию света одноклеточных микроорганизмов находятся в условиях, где источники легкодоступных электронов отсутствуют, и они вынуждены с большой затратой энергии отбирать их у воды – вещества, которое в большем или меньшем количестве присутствует повсеместно. В процессе эволюции живого у таких автотрофных клеток возникла дополнительная фотосистема – ФС II, которая за счет лучистой энергии приобретает способность окислять кислород воды. В результате согласованной работы ФС I и ФС II в мембранах хлоропластов возникает ток электронов от воды к NADP+ через цепь пигментов. В фотосистеме II антенные молекулы хлорофилла передают возбужденные электроны на фотореакционный центр, от которого они поступают на пластохинон (он аналогичен убихинону в мембранах митохондрий):

затем на цитохромы b и f (сyt b, сyt f) и далее через пластоцианин на фотореакционный центр ФС I. Молекулы хлорофилла в фотохимическом реакционном центре ФС II после передачи возбужденных электронов молекулам пластохинона превращаются в ион-радикалы (P680+·), которые получают электроны от молекул воды через окислительно-восстановительную систему, основанную на металлопротеине, в состав которого входит ион марганца Mn2+. Фотореакционный центр ФС I, представляющий собой белково-хлорофилловый пигмент (P700), отдает электроны ферредоксину – металлопротеину с атомами железа в окружении сульфидных групп. Эти посредники с помощью фермента ферредоксин-NADP+-оксидоредуктазы восстанавливают никотинамидадениндинуклеотидфосфат:
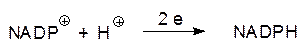
Энергия электронов в ФС II используется также для создания градиента концентраций ионов водорода с подкислением (рН ≈4,0) внутренней среды тилакоидов, то есть градиент концентраций создается между внутритилакоидным пространством и стромой. Как и в окислительном фосфорилировании протоны проходят через АТФ‑синтетазу, но в этом случае ее выступающаяся из мембраны субъединица F1 направлена в сторону стромы. Комплекс из ФС I и ФС II работает достаточно гибко. Если нет необходимости в восстановительном потенциале (весь NADP+ превратился в NADPH), то электрон от ФС II не поступает в цепь переноса электронов ФС I, а возвращается на пигменты ФС II и в циклическом процессе продолжает участвовать в создании градиента концентрации протонов, обеспечивая работу АТФ-синтетазы. Механизм переноса протонов в электрон-переносящей цепи в мембране тилакоида аналогичен тому, который рассматривался при изучении окислительного фосфорилирования (см. стр. 162–164). Здесь также определенную роль играет вода, но если при окислительном фосфорилировании перенос электронов на молекулу кислорода приводил к связыванию четырех протонов с образованием воды, то в фотосинтезе при окислении молекулы воды остаются два протона. В соответствии с этим ферментная система, окисляющая воду и генерирующая кислород, расположена на внутренней стороне мембраны тилакоида и подкисляет его внутреннее пространство.
В 1937 г. профессор Кембриджского университета Р. Хилл показал, что выделение кислорода и восстановление диоксида углерода не связаны в единый процесс. Он облучал светом суспензию хлоропластов, выделенных из растительных клеток, в растворе синего красителя, восстановленная форма которого бесцветна. При этом оказалось, что обесцвечивание красителя, сопровождающееся выделением кислорода, идет только на свету, и роль лучистой энергии сводится таким образом к индукции переноса электронов от кислорода воды к акцептору по уравнению:

Это уравнение в общем виде называют реакцией Хилла, а А – реагентом Хилла. Интенсивность этого упрощенного варианта фотосинтеза легко определяется спектрофотометрически по изменению оптической плотности раствора красителя, и поэтому реакцию Хилла часто используют для оценки биологической активности гербицидов, механизм действия которых направлен на ингибирование фотосинтеза. В стандартных условиях можно сравнивать различные фитоактивные вещества без учета факторов детоксикации, активации или транспорта в многоклеточном растении. В хлоропластах роль реагента Хилла выполняет NADP+.
Многоступенчатый путь окислительно-восстановительных превращений пигментов в мембранах хлоропластов очень уязвим. Многие вещества могут вмешиваться в этот процесс, блокируя перенос электронов от одного члена цепи к другому. В частности, мочевинные и триазиновые гербициды – диурон и симазин:
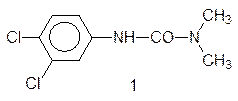
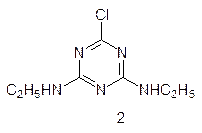
связываются с регуляторным центром белково-хлорофиллового комплекса ФС II и останавливают перенос электронов на пластохинон. Тогда возбужденные электроны переходят на кислород, и превращают его в сильнейший окислитель ион-радикал супероксид – О2–•, который вызывает окислительную деструкцию липидных составляющих клеточных мембран и гибель растения.
Действие дипиридиллиевых солей основано на вмешательстве в функционирование ФС I. Такие вещества, как паракват, очень близки по потенциалу восстановления к NADP+ и, конкурируя с ним в активном центре ферредоксин-NADP+-оксидоредуктазы, принимают электроны, превращаясь в сравнительно устойчивые окрашенные свободные радикалы (на схеме приведена одна из шести возможных мезомерных структур):
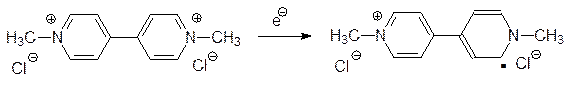
Образовавшийся свободный радикал (у параквата он окрашен в фиолетовый цвет) отдает неспаренный электрон кислороду, возвращается в исходное состояние и может снова принимать электрон в ФС I:
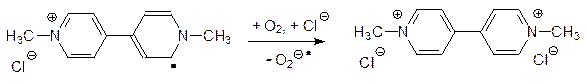
Превратившаяся в супероксид молекула кислорода запускает цепь окислительных превращений в растительных клетках, вызывая их гибель.
Каким же образом идет фиксация диоксида углерода при фотосинтезе? Опыты с меченным по углероду CO2 показали, что у большинства растений первым соединением с радиоактивной меткой оказывается 3-фосфоглицерат и лишь потом это соединение превращается в другие вещества с бóльшим или меньшим количеством атомов углерода. Было установлено, что образование 3-фосфоглицерата протекает с помощью фермента рибулозодифосфаткарбоксилазы, локализованной на поверхности тилакоидных мембран. Этот самый распространенный фермент биосферы имеет молекулярную массу около 550 кДа, и в его состав входят 8 каталитических и 8 регуляторных субъединиц. Химизм процесса представляется следующим образом: енольная форма 1,5-дифосфорибулозы образует стабильный нуклеофильный анион, который при ферментативном катализе реагирует с диоксидом углерода с образованием аниона фосфорилированной b‑кетокислоты, разлагающейся водой с разрывом C–C-связи между вторым и третьим углеродным атомами углеродного скелете рибулозы:
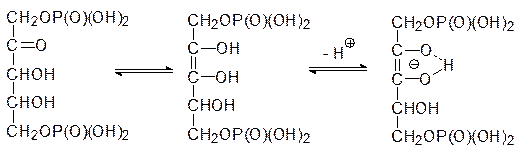
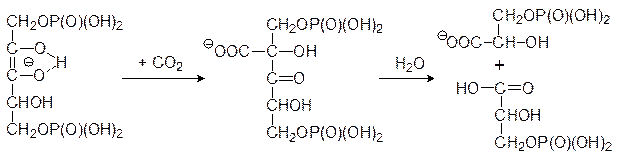
Дальнейшие превращения молекул фосфоглицерата описываются циклом Кальвина. Двенадцать молекул фосфоглицерата, образовавшихся в результате присоединения шести молекул диоксида углерода к шести молекулам дифосфорибулозы, фосфорилируются АТФ по карбоксильной группе и восстанавливаются действием NADPH до фосфоглицеринового альдегида. После этого пять молекул фосфоглицеринового альдегида изомеризуются в фосфат диоксиацетона. По реакции, обратной начальному этапу гликолиза, из трех молекул фосфоглицеринового альдегида и трех молекул фосфата диоксиацетона образуются три молекулы 6-фосфофруктозы. Одна молекула 6-фосфофруктозы выводится из цикла и включается в обычные метаболические процессы (например, идет на биосинтез крахмала), а две оставшихся реагируют с двумя молекулами 3-фосфоглицеринового альдегида по схеме
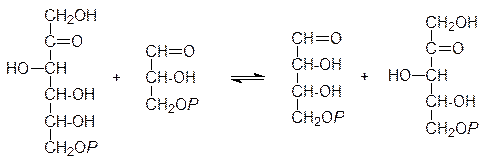
Эта катализизируемая транскетолазой реакция приводит к образованию эритрозо-4-фосфата и ксилулозо-5-фосфата. Две молекулы эритрозо-4-фосфата и две молекулы фосфата диоксиацетона при катализе альдолазой реагируют с образованием двух молекул соответствующей дифосфогептулозы, гидролизующейся до 7‑фосфоседогептулозы. Затем две молекулы 7-фосфоседогептулозы и две молекулы фосфоглицеринового альдегида при катализе транскетолазой по аналогии с приведенной выше схемой превращаются в две молекулы 5-фосфорибулозы и две молекулы 5-фосфоксилулозы, а четыре молекулы 5-фосфоксилулозы (две из этой и две из предыдущей реакции) при катализе соответствующей эпимеразой также превращаются в 5-фосфорибулозу. В общем виде это представляется схемой:


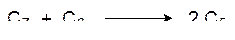
Все эти превращения относятся к реакциям, для протекания которых свет уже не нужен, их протекание обеспечивается накопленными в процессе фотосинтеза аденозинтрифосфатом и NADPH, поэтому их называют темновыми реакциями. Аллостерическим ферментом в реакции фиксации диоксида углерода является рибулозодифосфаткарбоксилаза. Ее положительными эффекторами являются ионы магния, протоны и NADPH, а это означает, что несмотря на кажущуюся независимость от света процесс фиксации CO2 с максимальной скоростью идет только на свету, так как повышение кислотности внутритилакоидного пространства и накопление восстановительного потенциала непосредственно связаны с поглощением света пигментами мембраны тилакоида.
К числу темновых реакций относится и дыхание растений – комплекс окислительных превращений образовавшихся в ходе фотосинтеза веществ. Но есть и световое дыхание, при котором образуется фосфогликолят. Оказалось, что рибулозодифосфаткарбоксилаза может катализировать также взаимодействие рибулозодифосфата с кислородом, в ходе которого образуется фосфоглицерат и фосфогликолят:
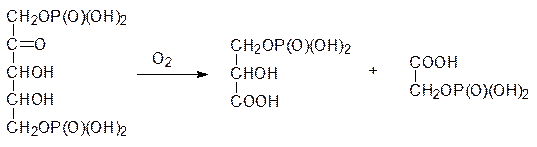
В солнечный безветренный день концентрация диоксида углерода в припочвенных слоях воздуха резко снижается в резльтате фиксации его растениями, и тогда с дифосфатом рибулозы вместо диоксида углерода начинает реагировать кислород. Образовавшаяся при этом фосфогликолевая кислота не может ассимилироваться в углеводы, и ее дальнейшее превращение идет по катаболическому пути. В результате светового дыхания при казалось бы благоприятных погодных условиях растения не накапливают биомассу и могут ее даже терять. В условиях жаркого климата очень часто максимальная инсоляция совпадает с безветренной погодой, поэтому многие южные растения используют вспомогательный путь фиксации диоксида углерода, когда первичным продуктом, в который ассимилируется диоксид углерода, является щавелевоуксусная кислота. Осуществляющий этот процесс фермент не переключается на работу с кислородом. После этого в растительных клетках оксалоацетат декарбоксилируется, и выделяющийся диоксид углерода создает достаточно высокую локальную концентрацию в клетках растения, обеспечивая эффективную работу рибулозодифосфаткарбоксилазы и протекание цикла Кальвина. В отличие от С3‑растений, у которых первичным продуктом присоединения СО2 является фосфоглицерат, такие растения называют С4-растениями (в молекуле оксалоацетата четыре атома углерода). К ним относятся, например, кукуруза, сахарный тростник и просо.
 2020-10-10
2020-10-10 1039
1039
