| Формула кислоты | Название кислоты | Анион | Название соли |
| 1 | 2 | 3 | 4 |
| H3BO3 | Ортоборная | BO3 3- | Ортоборат |
| H2B2O7 | Тетраборная | B2O7 2- | Тетраборат |
| HBr | Бромоводородная | Br - | Бромид |
| HBrO | Бромноватистая | BrO - | Гипобромит |
| HBrO3 | Бромноватая | BrO3 - | Бромат |
| HCOOH | Муравьиная | HCOO - | Формиат |
| CH3СOOH | Уксусная | CH3СOO - | Ацетат |
| HCN | Циановодородная (синильная) | CN - | Цианид |
| H2CO3 | Угольная | CO3 2- | Карбонат |
| HCO3 - | Гидрокарбонат | ||
| H2C2O4 | Щавелевая | C2O4 2- | Оксалат |
| HCl | Хлороводородная (соляная) | Cl - | Хлорид |
| HClO | Хлорноватистая | ClO - | Гипохлорит |
| HClO2 | Хлористая | ClO2 - | Хлорит |
| HClO3 | Хлорноватая | ClO3 - | Хлорат |
| HClO4 | Хлорная | ClO4 - | Перхлорат |
| HCrO2 | Метахромистая | CrO2 - | Метахромит |
| H2CrO4 | Хромовая | CrO4 2- | Хромат |
| H2Cr2O7 | Двухромовая | Cr2O7 2- | Бихромат |
| HI | Йодоводородная | I - | Иодид |
| HIO | Йодноватистая | IO - | Гипоиодид |
| HIO3 | Йодноватая | IO3 - | Иодат |
| HIO4 | Йодная | IO4 - | Периодат |
| HMnO4 | Марганцовая | MnO4 - | Перманганат |
| H2MnO4 | Марганцовистая | MnO4 2- | Манганат |
| HNO2 | Азотистая | NO2 - | Нитрит |
| HNO3 | Азотная | NO3 - | Нитрат |
| H3PO2 | Фосфорноватистая | H2PO2 - | Гипофосфит |
| H3PO3 | Фосфористая | HPO3 2- | Фосфит |
| HPO3 | Метафосфорная | PO3 - | Метафосфат |
| H3PO4 | Ортофосфорная | PO4 3- | Ортофосфат |
| HPO4 2- | Гидрофосфат | ||
| H2PO4 - | Дигидрофосфат | ||
| H4P2O7 | Пирофосфорная | P2O7 4- | Пирофосфат |
| H2S | Сероводородная | S 2- | Сульфид |
| HS - | Гидросульфид | ||
| HSCN | Роданистоводородная | SCN - | Роданид |
Продолжение приложения 2
| 1 | 2 | 3 | 4 |
| H2SO3 | Сернистая | SO3 2- | Сульфит |
| HSO3 - | Гидросульфит | ||
| H2SO4 | Серная | SO4 2- | Сульфат |
| HSO4 - | Гидросульфат | ||
| H2S2O3 | Тиосерная | S2O3 2- | Тиосульфат (гипосульфит) |
| H2S2O7 | Пиросерная | S2O7 2- | Пиросульфат |
| H2S2O8 | Пероксодисерная | S2O8 2 - | Персульфат |
| H2SiO3 | Кремневая | SiO3 2- | Силикат |
Схемы названия солей:
а) средней соли: кислотный остаток + название катиона (В родительном падеже);
б) основной соли: гидроксо + кислотный остаток + название катиона (В родительном падеже);
в) кислой соли: гидро + кислотный остаток + название катиона (В родительном падеже).
Некоторые важнейшие бинарные неорганические соединения:
 - оксиды;
- оксиды;  - гидриды;
- гидриды;  - фториды, хлориды, бромиды, йодиды;
- фториды, хлориды, бромиды, йодиды;  - сульфиды;
- сульфиды; 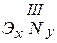 - нитриды;
- нитриды;
 - силициды;
- силициды;  - карбиды;
- карбиды;  - фосфиды.
- фосфиды.
Способы выражения концентраций растворов:
1. Массовая доля  (%)
(%)
2. Молярная концентрация  [моль/л].
[моль/л].
3. Молярная концентрация эквивалентов  [н]
[н]
4. Моляльная концентация  [моль/кг].
[моль/кг].
5. Мольная доля  ; Для двухкомпонентного раствора, состоящего из А и В, для вещества А:
; Для двухкомпонентного раствора, состоящего из А и В, для вещества А:  .
.
Титр  [г/мл].
[г/мл].
Разбавление V1C1=V2C2.
Количество вещества в растворе:
а)  ; б)
; б)  .
.
Приложение 3. Степень диссоциации кислот и оснований в водных растворах (0,1 н., 18 0С).
| Название кислоты или основания | Формула | a, % |
| Плавиковая | HF | 7 |
| Азотная | HNO3 | 92 |
| Соляная | HCl | 91 |
| Бромоводородная | HBr | 90 |
| Йодоводородная | HI | 90 |
| Серная | H2SO4 | 58 |
| Ортофосфорная | H3PO4 | 36 |
| Сернистая | H2SO3 | 20 |
| Уксусная | CH3COOH | 1,3 |
| Угольная | H2CO3 | 0,17 |
| Сероводородная | H2S | 0,07 |
| Ортоборная | H3BO3 | 0,01 |
| Синильная | HCN | 0,007 |
| Гидроксид калия | KOH | 89 |
| Гидроксид натрия | NaOH | 84 |
| Гидроксид аммония | NH4OH | 1,3 |
* Для сильных электролитов приведены их кажущиеся степени диссоциации. Числа для многоосновных кислот относятся к первой ступени диссоциации.
** Электролиты:
| Сильные | Слабые | |
| a > 30 % | a < 2% |
 2020-10-10
2020-10-10 252
252








