| Название электролита | Формула | Выражение для константы диссоциации | Значение К при 25 0С |
| Уксусная Кислота | СН3СООН | 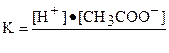
| K=1,8·10-5 |
| Муравьиная кислота | HCOOH | 
| K=1,8·10-4 |
| Азотистая кислота | HNO2 | 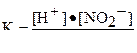
| K=4·10-4 |
| Синильная кислота | HCN | 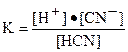
| K=7,9·10-10 |
| Сероводородная кислота | H2S |  
| K1 =6,0·10-8 K2 =1,0·10-14 |
| Угольная кислота | H2CO3 | 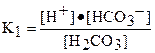 
| K1 =4,5·10-7 K2 =4,7·10-11 |
| Щавелевая кислота | H2C2O4 | 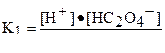 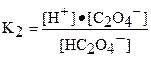
| K1 =5,4·10-2 K2 =5,4·10-5 |
| Сернистая кислота | H2SO3 |  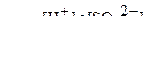
| K1 =1,6·10-2 K2 =6,3·10-8 |
| Фосфорная кислота | H3PO4 | 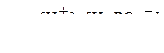  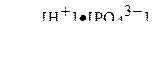
| K1 =7,5·10-3 K2 =6,3·10-8 K3 =1,3·10-12 |
| Гидроксид аммония | NH4OH | 
| K =6,3·10-5 |
| Вода | H2O | 
| K =1,86·10-16 |
Приложение 5. Стандартные окислительно-восстановительные потенциалы
(по отношению к потенциалу стандартного водородного электрода при 25 0С)
| Окисленная форма | Число получаемых электронов | Восстановленная форма | Е°, В |
| Li + | 1 | Li 0 | —3,045 |
| Rb+ | 1 | Rb0 | —2,25 |
| К+ | 1 | К 0 | —2,925 |
| Cs+ | 1 | Cs0 | —2,923 |
| Ва2+ | 2 | Ва0 | —2,900 |
| Sr 2+ | 2 | Sr0 | —2,890 |
| Са2+ | 2 | Са0 | —2,870 |
| Na + | 1 | Na0 | —2,714 |
| La3+ | 3 | La0 | —2,522 |
| Mg2+ | 2 | Mg0 | —2,370 |
| АlO2- + 2Н2O | 3 | A10 + 4OH- | —2,350 |
| Ве2+ | 2 | Be0 | —1,847 |
| А13+ | 3 | Al0 | — 1,662 |
| ZnO22- + 2H2O | 2 | Zn0 + 4OH- | — 1,216 |
| Мn2+ | 2 | Mn0 | — 1,180 |
| SO4 2- + H2O | 2 | SO3 2- + 2OH- | —0,930 |
| 2Н2О | 2 | H20 + 20H- | —0,828 |
| Zn2+ | 2 | Zn0 | —0,763 |
| Сr3+ | 3 | Cr0 | —0,744 |
| Fe3+ | 2 | Fe0 | —0,440 |
| 2Н+ (10 -7 М) | 2 | H20 | —0,414 |
| Cd2+ | 2 | Cd+ | —0,403 |
| Т13+ | 1 | Ti2 + | —0,370 |
| PbSO4 | 2 | Pb0 + SO42- | —0,356 |
| In3+ | 3 | In0 | —0,343 |
| Tl+ | 1 | Тl0 | —0,336 |
| Co2+ | 2 | Co0 | —0,277 |
| Ni2+ | 2 | Ni0 | —0,250 |
| Sn2+ | 2 | Sn0 | —0,136 |
| (CrO4)2- + 4H20 | 3 | Cr(OH)3 + 5OH- | —0,130 |
| Pb2 + | 2 | Pb0 | —0,126 |
| Fe3+ | 3 | Fe0 | —0,036 |
| 2H+ | 2 | H20 | 0,000 |
| NO3- + H2O | 2 | NO- + 2OH- | +0,010 |
| S0 + 2H+ | 2 | H2S | +0,141 |
| Sn4+ | 2 | Sn2+ | +0,150 |
| Cu2+ | 1 | Cu+ | +0,153 |
| SO42- + 4H+ | 2 | H2SO3 + H2O | +0,170 |
| AgCl | 1 | Ag0 + Cl- | +0,222 |
Продолжение таблицы 5
| Окисленная форма | Число получаемых электронов | Восстановленная форма | Е°, В |
| 2SO42- + 10H+ | 8 | S2O3 2- + 5H2O | +0,290 |
| ClO3- + H2O | 2 | ClO2- + 2OH- | +0,330 |
| Cu2+ | 2 | Cu0 | + 0,337 |
| [Fe(CN)6] 3- | 1 | [Fe(CN)6] 4- | +0,360 |
| SO42- + 8H + | 6 | S0 + 4H2O | +0,360 |
| ClO4- +H2O | 2 | Cl- + 2OH- | +0,360 |
| O2 + 2Н2О | 4 | 4OH- | +0,401 |
| H2SO3 + 4H + | 4 | S0 + 3H2O | +0,450 |
| Cu + | 1 | Cu0 | +0,521 |
| I2 | 2 | 2I- | +0,536 |
| H3AsO4 + 2H+ | 2 | HAsO2 + 2H2O | +0,559 |
| MnO4- | 1 | MnO4- | +0,564 |
| MnO4- | 3 | MnO2 + 4OH- | +0,588 |
| MnO4- + 2H2O | 2 | MnO2 + 4OH- | +0,600 |
| ClO- + HH2O | 2 | C1O- + 2OH- | +0,660 |
| О2 + 2Н + | 2 | H2O2 | +0,682 |
| BrO- + H2O | 2 | Br - + 2OH- | +0,760 |
| Fe3+ | 1 | Fe2+ | +0,771 |
| NO3- + 2H + | 1 | NO2 + H2O | +0,790 |
| Hg22+ | 2 | 2Hg0 | +0,798 |
| Ag+ | 1 | Ag0 | +0,799 |
| O2 + 4H + (10-7 M) | 4 | 2H2O | +0,815 |
| Hg2+ | 2 | Hg0 | +0,854 |
| ClO- + H2O | 2 | C1- + 2OH- | +0,890 |
| NO3- + 3H+ | 2 | HNO2 + H2O | +0,940 |
| NO3- + 4H+ | 3 | NO0 + 2H2O | +0,960 |
| HNO2 + H+ | 1 | NO0 + H2O | + 1,000 |
| Br2 | 2 | 2Br - | + 1,065 |
| IO3- + 6Н+ | 6 | I- + 3H2O | +1,090 |
| 2IO3- +12H+ | 10 | I2 + 6H2O | + 1,195 |
| C1O4- + 2H+ | 2 | ClO3- + H2O | + 1,190 |
| O2 + 4H+ | 4 | 2H2O | + 1,229 |
| MnO2 + 4H+ | 2 | Mn2+ + 2H2O | + 1,230 |
| T13 + | 3 | Тl0 | +1, 250 |
| HBrO + H+ | 2 | Br - + H2O | + 1,330 |
| Cr2O72- + 14H+ | 6 | 2Cr3+ + 7H2O | + 1,330 |
| C12 | 2 | 2C1- | + 1,359 |
| ВrO3- + 6Н+ | 6 | Br- + 3H2O | + 1,440 |
| C1O- + 6H+ | 6 | Сl- + ЗН2O | + 1,450 |
Продолжение таблицы 5
| Окисленная форма | Число получаемых электронов | Восстановленная форма | Е°, В |
| PbO2 + 4H+ | 2 | Рb2+ + 2Н2О | + 1,456 |
| 2ClO3- + 12H+ | 10 | Cl2 + 6H2O | + 1,470 |
| Au3+ | 3 | Au0 | + 1,500 |
| MnO4 - +8H+ | 5 | Мn2+ + 4Н2О | + 1,510 |
| 2ВrO3- + 12Н+ | 10 | Вг2 + 6Н2О | + 1,520 |
| PbO2 + 4H+ +SO42- | 2 | РbSО4 + 2Н2О | + 1,685 |
| MnO4- + 4H+ | 3 | МnО2 + 2Н2О | + 1,695 |
| H2O2 + 2H+ | 2 | 2Н2О | + 1,776 |
| Co3+ | 1 | Со2+ | +1,810 |
| F2 | 2 | 2F- | +2,870 |
 2020-10-10
2020-10-10 141
141








