Работа 1.Оценка генетического эффекта облучения животных с помощью микроядерного теста
В 1975 г. О. Schmidt предложил использовать для первичной прижизненной оценки мутагенеза метод подсчета микроядер в полихроматофильных эритроцитах костного мозга, который в последнее время получил широкое распространение в научных исследованиях. Появление микроядерных эритроцитов индуцирует облучение, алкилирующие агенты, сильные антиметаболиты и т.д.
С целью проведения быстрой и эффективной оценки повреждения хромосом Schlege, Mac Iugor (1983) предложили изучать частоту микроядер в эритроцитах периферической крови. К достоинствам микроядерного теста относится сравнительная быстрота анализа. Если традиционными методами (в том числе анализ метафазных пластинок) для оценки цитогенетических аберрацийодного индивида требуется 1-2 рабочих дня, то при исследовании теста на микроядра приблизительно 1 час. Путем подсчета микроядер можно преодолеть также сложность анализа картины метафазных хромосом. Этот тезис подтверждает приведенная в литературе корреляция между частотой обнаружения микроядерных эритроцитов и цитогенетических аберраций.
Действие мутагенов на организм индуцирует в клетках нарушения генома и структуры хромосом, которые, по-видимому, являются источником образования микроядер в эритроцитах костного мозга и периферической крови. В механизме образования микроядер ведущая роль отводится ацентрическим фрагментам хромосом. Фрагменты хромосом (хроматид), возникшие в результате разрывов хромосом и дисфункции веретена деления, окружаются мембраной и образуют микроядра. Существует мнение, что образование «крупных» микроядер тесно связано с геномными нарушениями хромосомного аппарата, в то время как уровень клеток с «мелкими» микроядрами коррелирует с частотой нарушений в структуре хромосом.
Работа проводится на трёх мышах, две из которых за 3-5 дней до занятия были подвергнуты облучению в дозах 3 и 6 Гр. У здорового и облучённых животных берут кровь из надреза кончика хвоста и готовят мазки. Затем мазки крови фиксируют в течение 5-10 мин в метаноле, после чего окрашивают азурII-эозином по общепринятой методике. Подсчёт микроядер проводят в расчёте на 1000 эритроцитов. При подсчёте микроядра делят на 2 группы: 1 – не превышающими 1/10 диаметра эритроцита; 2 – соответствующими 1/10-1/16 диаметра эритроцита. Строят графики, отражающие дозовую зависимость индуцированных цитогенетических нарушений в гемопоэтических клетках.
Работа 2.Приготовление и анализ метафазных пластинок хромосом клеток костного мозга облученных крыс
В опыте используют группы облученных и необлученных животных (см. работу 1). Крысам вводят колхицин внутрибрюшинно в количестве 0,2 мл 0,1 % раствора на 100 г массы тела. Через 1,5 часа животных умерщвляют с помощью эфира или методом дислокации цервикального отдела позвоночника согласно методическим рекомендациям МЗ СССР «Эвтаназия экспериментальных животных» (1985). Бедренную кость выделяют и очищают от мягких тканей. Костный мозг из бедренной кости вымывают 0,56 % раствором хлористого калия подогретого до 37 ºС. В этом растворе костный мозг помещают в термостат (37 ºС) на 20 мин. Затем клеточную суспензию центрифугируют при 1000 об./мин в течение 5 мин, надосадочную жидкость сливают и к полученному осадку по стенке пробирки (очень осторожно!) наливают охлажденную в холодильнике фиксирующую смесь (3 части абсолютного метилового или этилового спирта и 1 часть ледяной уксусной кислоты).
Фиксацию клеток производят в течение 15-20 мин при 4ºС (в холодильнике). Затем пастеровской пипеткой смесь слегка ресуспендируют и оставляют в холодильнике еще на 10-15 мин. После этого клеточную взвесь ресуспендируют более тщательно и центрифугируют 5 мин.
Надосадочную жидкость сливают, полученный осадок снова заливают фиксатором, тщательно разбивают клетки костного мозга пастеровской пипеткой и ставят в холодильник. Через 15-20 мин вновь ресуспендируют, затем центрифугируют 5 мин, заливают свежим фиксатором и помещают в холодильник (10-15 мин).
Таким образом, после трехкратного центрифугирования и фиксации, готовят препараты костного мозга. Для этого одну каплю взвеси разбрызгивают на охлажденном предметном стекле и высушивают над пламенем спиртовки. Красят препараты азурII-эозином в течение 30 мин.
Под воздействием ионизирующей радиации в клетках костного мозга возникают хромосомные аберрации. Хромосомные аберрации подразделяют на два типа: структурные хромосомные и хроматидные. Перестройки хроматидного типа – единичные перестройки, т.е. когда поражена одна хроматида; перестройки хромосомного типа – двойные перестройки, т.е. когда в аберрации вовлечены обе хроматиды.
Считают, что аберрации хромосомного типа отражают поражение хромосом на стадии G1, когда хромосома реагирует как однонитчатая структура. Аберрации хроматидного типа происходят при действии на стадии S и G2, когда хромосома реагирует как двунитчатая структура.
Аберрации хромосомного типа:
1. Ацентрические фрагменты (терминальные делеции) представляют собой спаренные хроматиды, которые располагаются параллельно друг другу, но не имеют центромеры.
2. Точковые фрагменты представляют собой спаренные хроматиды и имеют вид спаренных хроматиновых шариков.
3. Кольцевые хромосомы (центрические кольца) представляют собой спаренные хроматиды в виде кольца, имеющие центромеру.
4. Хромосомы, имеющие более одной центромеры (дицентрические, трицентри-ческие) являются межхромосомными асимметрическими транслокациями.
5. Симметричные межхромосомные обмены (транслокации) представляют собой аберрации, возникающие в результате обмена между двумя хромосомами, причем дистальные участки двух хромосом переносятся от одной к другой.
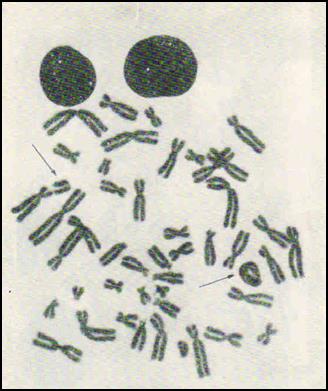
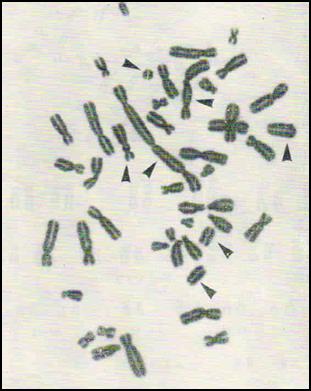
1. Клетка с центрическим кольцом и фрагментом. 2. Трицентрик + 2 дицентрические хромосомы +
4 ацентрических фрагмента.
 2020-10-11
2020-10-11 202
202








