| T 1, K | k 1, л/моль∙с | T 2, К | k 2, л/моль∙с | T 3, K | Δ T, K |
| 656 | 7,700 | 592 | 0,844 | 667 | 25 |
Решение. Энергию активации химической реакции можно опре-делить, используя значение констант скоростей k 1 и k 2 при двух значениях температуры Т 1 и Т 2, по уравнению
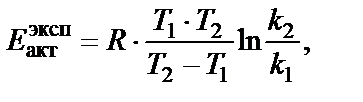
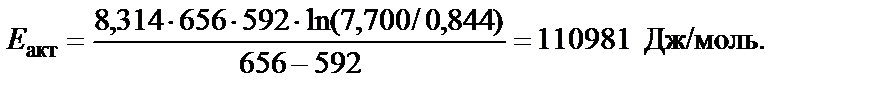
Пример 4. Определить температурный коэффициент Вант-Гоффа g для скорости реакции 2NO2 = 2NO + O2 в интервале температур
Т 1– Т 2.
| T 1, K | k 1, л/моль∙с | T 2, К | k 2, л/моль∙с |
| 656 | 7,700 | 592 | 0,844 |
Решение. Температурный коэффициент Вант-Гоффа γ для скоро-сти реакции в интервале температур Т 1/ Т 2 может быть рассчитан по формуле
k 1/ k 2 = 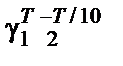
или для данной реакции k 1/ k 2 = 7,700/0,844 = γ656−592/10, отсюда γ = 1,4.
10. Физический смысл константы равновесия
химической реакции. Влияние различных факторов
на смещение химического равновесия. Принцип Ле-Шателье
Физический смысл константы равновесия химической реакции. Многие химические процессы в химико-технологических систе-мах являются двусторонними: они могут протекать как в прямом, так и в обратном направлении. Для большинства реакций скорость пря-мой реакции падает во времени, а скорость обратной реакции растет по мере накопления реагентов.
Например, взаимодействие водорода и азота имеет обратимый характер:
| г |
| г |
| г |
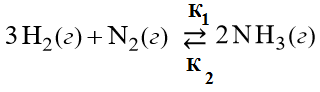 .
.
Скорость прямой реакции в начальный момент имеет наибольшее значение, а затем уменьшается вследствие уменьшения концентрации водорода и азота, которые расходуются на образование аммиака:
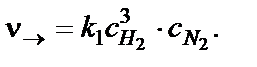
Скорость обратной реакции в начальный момент времени имеет минимальное значение, а затем увеличивается, по мере роста кон-центрации аммиака:
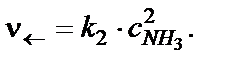
Через какое-то время скорости прямой и обратной реакции ста-новятся равными. Такое состояние реакционной системы называется химическим равновесием и определяется уравнением
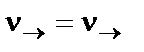 или
или 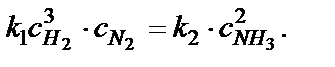
Отсюда получаем выражение для константы равновесия химической реакции − К равн:
| равн |
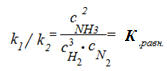 .
.
Константа равновесия химической реакции представляет собой отношение констант скорости прямой и обратной реакций или отно-шение произведений равновесных концентраций (активностей, парциальных давлений) продуктов реакции к произведению концентраций (активностей, парциальных давлений) исходных веществ.
В случае гетерогенной реакции, например,
| г |
| г |
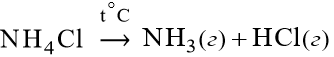
К равн. = с HCl∙ c NH3.
Состояние равновесия реакционной системы при данной темпе-ратуре не зависит от того, какие вещества, образующие систему, являются исходными, а какие − продуктами реакции.
Концентрации (активности, парциальные давления) участников реакции, которые соответствуют ее состоянию равновесия, называют равновесными концентрациями (активностями, парциальными давле-ниями). Они взаимно связаны друг с другом уравнением реакции и законом действия масс.
Значение константы равновесия химической реакции показы-вает, насколько полно при данных условиях исходные вещества пре-вратились в продукты реакции.
Например, если К равн. = 10−6, то можно сделать вывод, что реакция в прямом направлении при данных условиях (T, P) не идет и про-дуктов в равновесной смеси нет. Если же К равн.=106, то из этого следует, что исходные вещества практически полностью превратились в продукты реакции при данных условиях.
Смещение равновесия. Принцип Ле-Шателье. Изменение температуры системы, находящейся в состоянии равновесия и концентрации ее составных частей приводит к нарушению равенства скоростей прямой и обратной реакций. Такое состояние продолжается недолго. Через некоторое время равенство скоростей восстанавливается. Однако новое состояние равновесия смещено относительно первоначального в направлении той реакции, которая временно протекала с большей скоростью. Такой переход от одного равновесного состояния к другому называется смещением или сдвигом равновесия.
Направление, в котором происходит смещение равновесия при изменении температуры, можно определить, руководствуясь прави-лом Вант-Гоффа, согласно которому повышение температуры вызы-вает смещение равновесия в сторону реакции, идущей с поглощением теплоты, а понижение температуры − в сторону реакции, идущей с выделением теплоты.
Например, если реакция взаимодействия йода и водорода:
| k 2 |
| k 1 |
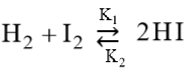 , Δ H o298 = 51,9 кДж
, Δ H o298 = 51,9 кДж
идет с поглощением тепла, а следовательно, обратная реакция − с выделением тепла, то при повышении температуры новое состояние равновесия окажется смещенным вправо, а при понижении темпе-ратуры – влево.
Так как с повышением температуры константы скорости прямой и обратной реакций k 1 и k 2 увеличиваются в различное число раз, то в новом состоянии равновесия константа К равн.= k 1/ k 2 будет иметь другое значение.
Направление, в котором происходит сдвиг равновесия при изме-нении концентрации составных частей системы, можно определить исходя из следующих соображений: при увеличении концентрации исходных веществ происходит сдвиг равновесия в сторону прямой реакции, а увеличение концентрации продуктов реакции вызывает смещения равновесия в обратном направлении.
Например, если в реакционной системе H2 + I2↔2HI увеличить концентрацию йода, то увеличится скорость прямой реакции, т.е. ре-акции образования HI. Концентрация же водорода уменьшится, по-скольку он расходуется на образование HI. В реакционной системе произойдет сдвиг равновесия вправо, константа равновесия при этом не изменится. К этому выводу можно прийти исходя из выражения К равн = k 1/ k 2.
Константы скорости прямой и обратной реакций не зависят от концентраций, и, следовательно, их отношение сохранит своё прежнее значение. Изменение давления также может вызвать смещение равно-весия в том случае, если в процессе реакции уменьшается или увели-чивается объем системы. При определении направления, в котором происходит сдвиг равновесия при изменении давления, следует помнить, что увеличение давления смещает равновесие в сторону образования тех продуктов, которые занимают меньший объем, и наоборот, уменьшение давления способствует смещению равновесия в сторону образования продуктов, занимающих больший объем. Так как в системе N2 + + 3H2→2NH3 объем образующегося аммиака в два раза меньше объема исходных газов, то увеличение давления вызывает смещение равновесия вправо, а уменьшение давления будет способствовать разложению аммиака на водород и азот.
Направление, в котором происходит сдвиг равновесия системы, может быть определено исходя из принципа Ле-Шателье: если из-менить одно из условий состояния системы, находящейся в равно-весии, – температуру, концентрацию, давление, то в системе усили-вается процесс, стремящийся свести это изменение к минимуму, т.е. ослабить его.
11. Ионные равновесия в растворах электролитов.
Водородный показатель рН. Гидролиз солей
Электролиты − это вещества, растворы или расплавы которых проводят электрический ток. Носителями зарядов являются поло-жительно заряженные ионы – катионы и отрицательно заряженные ионы – анионы. Заряженные частицы в растворах электролитов появляются в результате распада (диссоциации) молекул электролита на ионы, которые несут положительный или отрицательный заряд. Этот процесс называется электролитической диссоциацией и описывается уравнением AxBy ↔ xA + + yB или, конкретно, Al2(SO4)3 ↔ 2Al3+ + +3SO42−. Число положительных зарядов равно числу отрицательных, поэтому раствор в целом остается электронейтральным.
Электролитической диссоциации подвержены вещества с силь-ной полярной или ионной связью (соли, кислоты, основания) в раст-ворителях с полярными молекулами.
Диссоциация молекул электролита на ионы происходит за счет электростатического взаимодействия между полярными молекулами растворенного вещества и растворителя. Образовавшиеся ионы окру-жаются молекулами воды, т.е. происходит гидратация ионов.
Гидратация ионов является экзотермическим процессом, т.е. проходит с выделением тепла, причем данный тепловой эффект срав-ним с тепловыми эффектами химических реакций. Взаимодействие между ионами в растворе зависит от диэлектрической проницаемости растворителя – ε, которая показывает, во сколько раз сила взаимодействия между двумя зарядами в данной среде меньше, чем в ваку-уме.
Например, диэлектрическая проницаемость воды равна 81, т.е. взаимодействие между двумя зарядами в воде будет в 81 раз меньше, чем в вакууме. Поэтому чем выше диэлектрическая проницаемость растворителя, тем легче молекулы электролита распадаются на ионы. По своей способности к диссоциации электролиты условно делятся на сильные и слабые. В растворах слабых электролитов очень малая часть молекул распадается на ионы, в то время как сильные элект-ролиты диссоциируют почти полностью. К сильным электролитам относятся почти все соли, сильные кислоты (HCl, HNO3, HClO3, HClO4), гидроксиды щелочных и щелочно-земельных металлов (кроме Be(OH)2, Mg(OH)2).
К слабым электролитам относятся вода, большинство органиче-ских оснований и кислот, фенолы, аммиак, амины, угольная кислота
и т.д. В растворах слабых электролитов устанавливается равновесие между продуктами диссоциации – ионами и недиссоциированными молекулами [1].
Например, равновесие в растворе уксусной кислоты выражается следующим образом:
CH3COOH↔CH3COO- + H+.
Количественно распад молекул слабого электролита на ионы характеризуется степенью диссоциации – α (альфа):
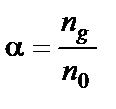 ,
,
где 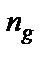 − число молекул, распавшихся на ионы, n 0 − общее число молекул растворенного вещества в растворе.
− число молекул, распавшихся на ионы, n 0 − общее число молекул растворенного вещества в растворе.
Степень диссоциации зависит от многих факторов, в частности от концентрации слабого электролита, поэтому для суждения о силе слабого электролита ввели понятие константы диссоциации.
Константа диссоциации в соответствии с законом действия масс для реакции CH3COOH↔CH3COO− + H+ выражается уравнением
| дисс |
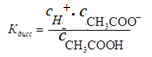 .
.
Константа диссоциации зависит от природы растворителя и от температуры. Выражение для константы диссоциации можно запи-сать, используя степень диссоциации и концентрацию слабого элект-ролита:
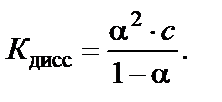
Если степень диссоциации α ≪ 1, то для приближенных расчетов получим
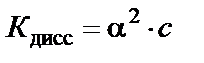 или
или 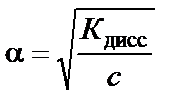 ,
,
где c – концентрация слабого электролита, моль/л.
Анализ этого уравнения позволяет сделать вывод о том, что с уменьшением концентрации слабого электролита степень диссоциа-ции электролита возрастает. Зная значение α, можно рассчитать равновесные концентрации ионов и недиссоциированных молекул слабого электролита в растворе:
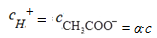 ,
,
С CH3COOH = с − α∙ с = (1 − α) с.
Сильные электролиты при растворении в воде полностью рас-падаются на ионы. Сильное взаимодействие между ионами и поляр-ными молекулами воды приводит к тому, что свойства раствора сильных электролитов значительно отличаются от свойства слабых, где межионным взаимодействием можно пренебречь. В связи с этим вместо термина «концентрация» введено понятие «активность».
Активность (а) – это эффективная концентрация с учетом электростатического взаимодействия между ионами в растворе. Активность отличается от концентрации на некоторую величину γ:
а = с γ,
где с − молярная концентрация, моль/л, γ − коэффициент активности. В сильно разбавленных растворах электролитов коэффициент актив-ности стремится к единице.
Выражение для констант диссоциации (ионизации) слабого электролита целесообразно писать, используя соответствующие активности:
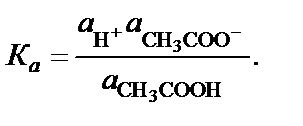
Химически чистая вода является слабым электролитом, и не-значительная часть молекул воды диссоциирует по уравнению
H2O↔OН− + H+.
Поэтому константа диссоциации воды
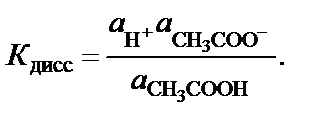
Термодинамические расчеты показывают, что диссоциации под-вержена лишь очень малая часть молекул воды. Поэтому можно считать, что равновесная концентрация недиссоциированных молекул во-ды практически равна общей концентрации, т.е.
c H2O = 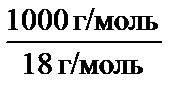 = 55,56 моль/л.
= 55,56 моль/л.
Следовательно, 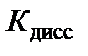 ∙ c H2O =
∙ c H2O = 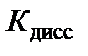 ∙55,56 = Кw, Кw – константа, которая называется ионным произведением воды. При t = 25 °С Кw = 10−14. Это означает, что если c H+ = 10−2 моль/л, то
∙55,56 = Кw, Кw – константа, которая называется ионным произведением воды. При t = 25 °С Кw = 10−14. Это означает, что если c H+ = 10−2 моль/л, то
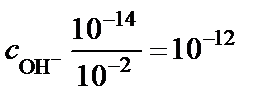 моль/л.
моль/л.
Таким образом, по значению Кw можно легко определить кон-центрацию ионов водорода при известной концентрации ОН-и на-оборот. В чистой воде с H+ = с ОН−= 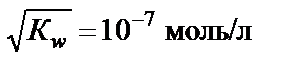 .
.
Для количественной характеристики реакции среды предложено использовать водородный показатель рН раствора (рН = −lgсH+). Аналогично существует и рОН раствора (pOH = − lgсОН−) соот-ветственно: рКw = рН + pOH = 14. Таким образом, в нейтральной среде рН =7, в кислой рН < 7, в щелочной рН > 7.
Гидролиз солей. Гидролизом называется обменное взаимодействие некоторых солей с водой, приводящее к образованию малодиссоциированных соединений (слабых кислот, слабых оснований или сложных ионов).
Гидролизу подвергаются соли, образованные:
· слабой кислотой и сильным основанием − CH3COONа- CH3COOН слабая кислота, NаОН – сильное основание; KCN-НСN − слабая кислота (цианистоводородная кислота), КОН – сильное основание);
· слабым основанием и сильной кислотой − NH4Cl, AgNО3;
· слабой кислотой и слабым основанием − NH4CH3COO,
Zn (CH3COO)2.
Пример. Рассмотрим реакцию гидролиза:
NH4Cl +H2О↔NH4ОН + НCl
NH4+ + Cl−+ H2О↔NH4ОН+ Н++Cl−
Сокращенное ионно-молекулярное уравнение реакции гидролиза:
NH4+ + H2О↔NH4ОН+ Н+
Наличие Н+ в правой части уравнения говорит о том, что реакция среды кислая, т.е. рН < 7. Процесс гидролиза характеризуется кон-стантой гидролиза К г.
В случае слабой кислоты
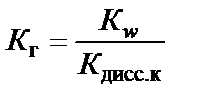 ,
, 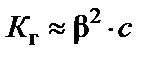 ,
,
где β − степень гидролиза соли; с − концентрация раствора соли, моль/л; 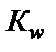 − ионное произведение воды.
− ионное произведение воды.
В случае слабого основания
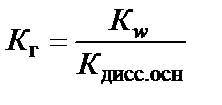 .
.
Если соль образована слабой кислотой и слабым основанием,
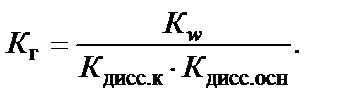
 2020-10-09
2020-10-09 112
112








