Пример 1. Рассчитать константу скорости реакции 2NO2 =
= 2NO + O2. Данные для расчета представлены в табл. 4.
Т а б л и ц а 4
Зависимость концентрации вещества от температуры
| t, °C | c .103, моль/л | t, °C | c .103, моль/л |
| 0 | 1,000 | 150 | 0,6632 |
| 60 | 0,8308 | 180 | 0,6212 |
| 120 | 0,7108 | 300 | 0,4954 |
Решение. Так как реакция 2NO2 = 2NO +O2 является реакцией второго порядка, константу скорости химической реакции рассчи-тываем по уравнению, записанному относительно времени:
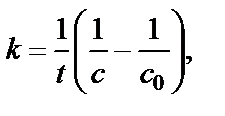 (конц.−1 время−1), (9)
(конц.−1 время−1), (9)
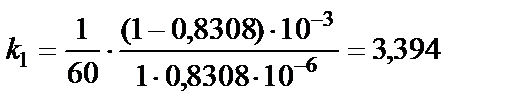 с−1∙моль−1∙л,
с−1∙моль−1∙л,
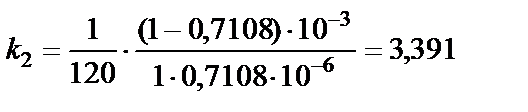 с−1∙моль−1∙л,
с−1∙моль−1∙л,
 с−1∙моль−1∙л,
с−1∙моль−1∙л,
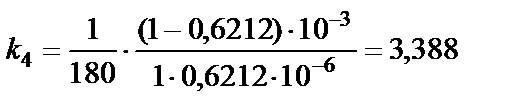 с−1∙моль−1∙л,
с−1∙моль−1∙л,
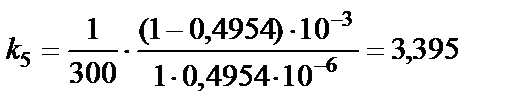 с−1∙моль−1∙л.
с−1∙моль−1∙л.
Константа скорости не зависит от времени, остается примерно постоянной. Таким образом, среднее значение константы скорости
k = 3,39 c−1 моль−1 л.
Пример 2. Рассчитать время, за которое прореагирует 10% исходного вещества в реакции 2NO2 = 2NO + O2.
Решение. Если к моменту времени t прореагировало 10% исход-ного вещества, то непрореагировшая часть исходного вещества к этому моменту времени составляет С = 0,9 С0 моль/л. Подстановка полученного выражения в уравнение для данной реакции [реакции второго порядка, уравнение (9)], записанного относительно времени, позволяет рассчитать время:
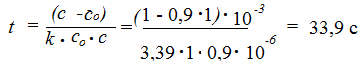 .
.
Пример 3. Определить энергию активации химической реакции 2NO2 = 2NO + O2, используя значение констант скоростей k 1 и k 2 при двух значениях температуры: Т 1 и Т 2 (табл. 5).
Т а б л и ц а 5
 2020-10-09
2020-10-09 263
263








