Пример 1. В каком направлении произойдет смещение равно-весия в системе H2 +S ⇄ H2S если увеличить концентрацию водорода?
Решение. Если увеличить концентрацию водорода, то увеличится скорость прямой реакции и произойдет сдвиг равновесия вправо, но константа равновесия при этом не изменится.
Пример 2. В каком направлении произойдет смещение равнове-сия при повышении давления в системе 2NO + O2 ⇄ 2NO2?
Решение. При повышении давления равновесие смещается в сто-рону тех реагентов, которые занимают меньший объем (т.е. в сторону реагентов – исходных или конечных, где меньше общее число моль газообразных веществ). В нашем случае равновесие смещается впра-во, так как там общее число молей равно двум, а слева – трем.
Пример 3. В каком направлении произойдет смещение равно-весия при повышении температуры системы COCl2⇄CO+Cl2? Δ H 0298= = 113 кДж?
Решение. Прямая реакция протекает с поглощением тепла, по-этому равновесие будет смещено вправо, так как в этом случае реакционная система уменьшает внешнее воздействие температуры.
Пример 4. В какую сторону сместится равновесие реакции
PCl5⇄ PCl3 + Cl2, ΔH0298 = 92,45 кДж, если повысить температуру на 30 °С? Температурный коэффициент прямой реакции равен 2,5, а обратной – 3,2.
Решение. Так как температурные коэффициенты прямой и об-ратной реакций не равны, повышение температуры по-разному ска-жется на изменении скоростей этих реакций. При повышении тем-пературы на 30 °С скорость прямой реакции
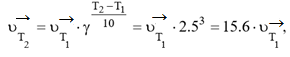
скорость обратной реакции
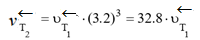 .
.
Таким образом, при повышении температуры скорость прямой реакции возросла в 15,6 раза, а обратной – в 32,8 раза. Следовательно, равновесие сместится в сторону обратной реакции.
Пример 5. Как изменится равновесие реакции
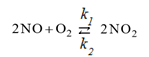 ,
,
если увеличить давление в реакционной системе в два раза?
Решение. До увеличения давления в системе выражения для скоростей прямой и обратной реакции будут следующими:
для прямой реакции 
для обратной реакции 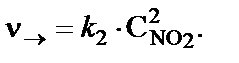
При увеличении давления в два раза концентрации всех реаги-рующих веществ увеличились в два раза, так как общий объем си-стемы уменьшился в два раза. Тогда скорости прямой и обратной реакций станут равными:
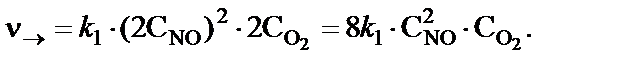
В результате увеличения давления скорости прямой и обратной реакций увеличились соответственно в восемь раз и четыре раза:

Таким образом, скорость прямой реакции будет в два раза больше, чем скорость обратной реакции. Следовательно, смещение равнове-сия произойдет слева направо, т.е. в сторону образования NО2.
Пример 6. Определить концентрацию гидроксид-ионов и рН в 0,01 М растворе гидроксида аммония.
Решение. Значение константы диссоциации NH4ОН Кд=1,77∙10−5. Электролитическая диссоциация гидроксида аммония описывается уравнением
NH4ОН↔NH4++ ОН−.
Так как имеем разбавленный раствор слабого электролита, то закон разбавления Оствальда можно использовать в виде 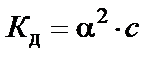 , откуда степень диссоциации NH4ОН
, откуда степень диссоциации NH4ОН
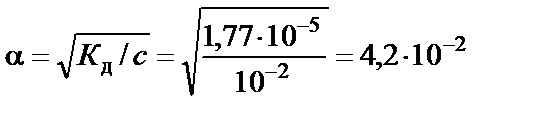 ,
,
тогда концентрация гидроксид-ионов:
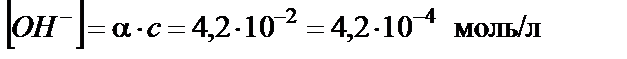
или
рОН = −lg[ ОH −]= −lg(4,2∙10−4) = 3,38;
рН = 14 − рОН = 14 − 3,38 = 10,62.
12. Электродные потенциалы, гальванические элементы.
Электрохимическая коррозия
Электрохимия является разделом физической химии, в котором изучают закономерности процессов, протекающих при взаимном превращении электрической и химической форм энергии.
В основе электрохимических процессов лежат окислительно-вос-становительные реакции, при протекании которых происходит одновременное окисление восстановителя и восстановление окислителя за счет перераспределения электронов:
Red1 + Ox2® Ox1 + Red2
Red1® Ox1 + nē – окисление
Ox2 + nē ® Red2 – восстановление,
где Red1 – восстановленная, а Ox1 – окисленная форма вещества 1, Red2, Ox2 − соответственно вещества 2 (Red – от reduction – вос-становление; Ox – от oxidation – окисление).
Процессы окисления и восстановления могут быть разделены в пространстве. В этом случае в реакционной системе может осущест-вляться перенос электронов между ее частями, т.е. будет протекать электрический ток.
Если окислительный и восстановительный процессы разделены в пространстве, то переход электронов от восстановителя к окислителю в самопроизвольном процессе (D rG < 0) может быть использован для получения электрической энергии. При использовании ее внешнего источника можно осуществлять вынужденные химические реакции (D rG > 0). Таким образом, происходит непосредственное взаимное превращение химической и электрической форм энергии. Такие окис-лительно-восстановительные процессы называются электрохимиче-скими и происходят в электрохимической системе (ЭХС) − рис. 6.
Электрод, на поверхности которого происходит реакция окисления, называется анодом, а на поверхности которого происходит реакция восстановления – катодом:
М1 x ® M1 x + n + nē – анодный процесс (Red1® Ox1 + nē),
М2 x + nē ® M2 x − n – катодный процесс (Ox2 + nē ® Red2).
Электрохимический процесс сопровождается переносом зарядов. Во внешней цепи электроны движутся от анода к катоду, а во внут-ренней происходит переход ионов.
| электроны |
| ионы |
| 1 |
| 1 |
| 3 |
| 5 |
| А |
| К |
| 2 |
| 2 |
| 4 |
Рис. 6. Электрохимическая система (ЭХС) включает в себя электроды 1 – проводники с электронным типом проводимости (чаще всего металл), находящиеся в контакте с электролитом; электролиты 2 – проводники с ионным типом проводимости (раствор веществ, диссоциирующих на ионы); внешнюю цепь 3 – проводники, обеспечивающие возможность перехода электронов между электродами (протекания электрического тока); внутреннюю цепь 4 – проводник с ионным типом проводимости, обеспечивающий возможность перехода ионов; проводник электрического тока или внешний источник электрической энергии − 5
ЭХС принято изображать в виде условной схемы: слева записы-вается анод с электролитом (А), справа катод с электролитом (К); граница раздела «электрод–электролит» обозначается вертикальной линией; граница раздела между анодным и катодным электролитами, обеспечивающая возможность перехода ионов (ионный проводник), – двумя вертикальными параллельными линиями.
Пример. Анод – цинк, находящийся в контакте с раствором суль-фата цинка; катод – медь, находящаяся в контакте с сульфатом меди:
(а)(−)Zn|ZnSO4||CuSO4|Cu(к)(+), или (а)(−)Zn|Zn+2||Cu+2|Cu(к)(+).
Если ЭХС находится в состоянии равновесия (D G = 0), то ток в цепи равен нулю. Во внешней цепи не происходит перенос элект-ронов и соответственно отсутствует направленное движение ионов во внутренней цепи.
Если в ЭХС протекает ток, то она выходит из состояния рав-новесия и электрохимический процесс становится неравновесным. Он является самопроизвольным, если D G < 0. Если D G > 0, то протекание вынужденного процесса обеспечивается включением во внешнюю цепь источника электрической энергии.
При самопроизвольном процессе в результате протекания реак-ций на поверхности электродов энергия химических связей превра-щается в электрическую. В этом случае электрохимическая система называется гальваническим элементом, который может служить химическим источником тока (ХИТ).
При осуществлении вынужденного электрохимического процесса за счет внешнего источника электрической энергии на поверхности электродов протекают реакции превращения веществ. При этом электрическая энергия переходит в энергию новых химических связей. Химические процессы, осуществляемые за счет электрической энергии, называются электролизом, а электрохимическая система – электролизером.
Изменение энергии Гиббса в электрохимическом процессе равно ее изменению в результате протекания химической реакции (D rG) плюс работа переноса электрических зарядов между электродами (W э), имеющими разность потенциалов (электродвижущую силу) Е, (E = ∆φ = jк – jа):
D G = D rG + W э ® D G = D rG + n×F×E,
где F – число Фарадея.
В состоянии равновесия D G = 0. Следовательно, разность по-тенциалов электродов равна: 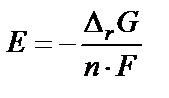 . Термодинамическое условие самопроизвольного протекания процесса – D rG < 0. Следовательно, при работе гальванического элемента E > 0 (так как n и F больше нуля). Если потенциал катода составляет величину jк, а потенциал анода jа, то E = jк – jа > 0 и jк > jа. В случае вынужденного процесса D rG > 0. Следовательно, при электролизе разность потенциалов электродов E < 0 и соответственно jк < jа.
. Термодинамическое условие самопроизвольного протекания процесса – D rG < 0. Следовательно, при работе гальванического элемента E > 0 (так как n и F больше нуля). Если потенциал катода составляет величину jк, а потенциал анода jа, то E = jк – jа > 0 и jк > jа. В случае вынужденного процесса D rG > 0. Следовательно, при электролизе разность потенциалов электродов E < 0 и соответственно jк < jа.
При записи электрохимических процессов принято обозначать электроды с относительно большим потенциалом знаком «+», а с относительно меньшим потенциалом − знаком «-». Таким образом, в гальваническом элементе потенциал анода будет отрицательным, а катода «положительным. В электролизере наоборот − анод будет «+», катод «-».
Скачок потенциала на границе «металл–электролит» возникает в системе, состоящей из металлического электрода, погруженного в раствор, содержащий катионы того же металла (раствор соли). Если металл находится в контакте, например, с водным раствором элект-ролита, то на границе раздела фаз «металл–электролит» протекают следующие процессы.
1. В результате физико-химического взаимодействия между ди-полями воды и поверхностными ионами металла происходит его растворение. Особенности химической связи в металлах приводят к тому, что в раствор переходят только ионы металла, а электроны ос-таются в кристалле. В результате электрод приобретает избыточный отрицательный, а раствор – избыточный положительный заряды. Этот процесс можно записать как реакцию окисления металла:
Me0 + x H2O®Me n +(H2O) x + nē.
2. Наличие катионов металла в растворе и отрицательный заряд электрода за счет избыточных электронов обусловливает протекание обратного процесса: катионы металла переходят из раствора на по-верхность электрода. При этом они теряют свою гидратную оболочку и встраиваются в кристаллическую решетку, что приводит к умень-шению величин отрицательного заряда электрода и положительного заряда раствора. Этот процесс можно записать как реакцию восстановления металла:
Me n +(H2O) x + nē ®Me0+ x H2O.
В результате протекания этих процессов система придет в со-стояние равновесия. Скорости первого и второго процессов будут равны:
Me n +(H2O) x + nē ↔ Me0+ x H2O или Me n ++ nē ↔ Me0.
При этом потенциал электрода и концентрация катионов в раст-воре сохранят постоянное равновесное значение.
На границе «электрод–электролит» возникает обменный двойной электрический слой, образованный с одной стороны избыточными электронами в электроде, а с другой – избыточными положительными ионами металла в растворе (противоионами). Он рассматривается как единая электронейтральная система: заряд электрода равен сумме зарядов противоионов.
Поскольку существует разделение зарядов в пространстве, то между металлом и раствором возникает разность потенциалов − j. Говорят, что при контакте металла с электролитом на границе раздела возникает скачок электрического потенциала – электродный потенциал.
Способов экспериментального определения и расчета абсолют-ных величин электродных потенциалов не существует. С достаточной степенью точности можно измерить разность потенциалов Dj между двумя электродами в ЭХС. Если равновесие в такой системе до-стигнуто в стандартных условиях: активность (концентрация) потенциалопределяющих ионов 1 моль/л; температура Т 0 = 298 К; давление газов р 0 = 1,013×105 Па, то измеряемая Dj равна разности между стандартными электродными потенциалами: Dj = j01-j02.
Если один из электродов принять в качестве электрода срав-нения, стандартный потенциал которого условно считать равным нулю, то измеренная разность потенциалов будет являться потенциалом второго электрода относительно первого. В качестве электрода сравнения используют стандартный водородный электрод, потенциал которого условно принят равным нулю (φ02Н/2Н+ = 0).
В рассматриваемой паре электродов потенциал стандартного во-дородного электрода может быть как больше, так и меньше стан-дартного потенциала измеряемого. Например, для металлических электродов электрохимические системы могут быть записаны как
(–)Me0|Men+||2H+|H20, Pt(+) или (–)H20, Pt |2H+||Men+|Me0(+).
Таким образом, потенциал измеряемого электрода относительно водородного может быть отрицательным: 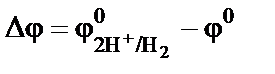 или поло-жительным:
или поло-жительным: 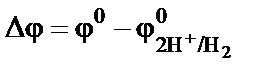 . За стандартный электродный потен-циал принимается измеренная разность потенциалов, соответственно
. За стандартный электродный потен-циал принимается измеренная разность потенциалов, соответственно
j0 = ±Dj.
Измеренные относительно водородного электрода величины стандартных электродных потенциалов сведены в таблицу в порядке их возрастания. Такую последовательность называют рядом стан-дартных электродных потенциалов (табл. 6).
Т а б л и ц а 6
Ряд стандартных электродных потенциалов металлов (В)
и классификация металлов по активности
| Активные | Средней активности | Неактивные | |||
| Li+/Li | −3,04 | Mn2+/Mn | −1,18 | Cu2+/Cu | +0,34 |
| K+/K | −2,92 | Zn2+/Zn | −0,76 | Ag+/Ag | +0,80 |
| Ca2+/Ca | −2,87 | Cr3+/Cr | −0,74 | Pt2+/Pt | +1,20 |
| Na+/Na | −2,71 | Fe2+/Fe | −0,44 | Au3+/Au | +1,50 |
| Mg2+/Mg | −2,38 | Ni2+/Ni | −0,25 | ||
| Al3+/Al | −1,66 | Sn2+/Sn | −0,14 | ||
| Pb2+/Pb | −0,13 | ||||
| 2H+/H2 | 0,00 | ||||
Для определения величины электродного потенциала в нестан-дартных условиях используют уравнение Нернста (9):
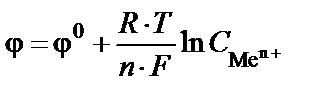 , (9)
, (9)
где R – универсальная газовая постоянная (R = 8,314 Дж/моль∙К); F – постоянная Фарадея, 96485 Кл/моль; Т − температура, К; n − число электронов, участвующих в электродном процессе; 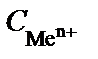 – концент-рация (активность) раствора электролита (ионов металла); φ0 – стан-дартный потенциал электрода, В.
– концент-рация (активность) раствора электролита (ионов металла); φ0 – стан-дартный потенциал электрода, В.
Из уравнения (9) следует, что потенциал электрода при данной температуре определяется стандартным электродным потенциалом (j0) и концентрацией (активностью) ионов, участвующих в реакции.
Для стандартной температуры (T = 298 K) уравнение (9) имеет вид
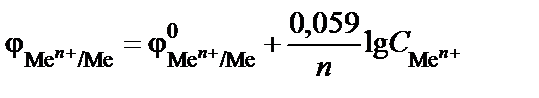 .
.
Гальванические элементы (ГЭ) представляют собой электрохи-мическую систему, состоящую из двух электродов с различными значениями электродных потенциалов. Если электродные потенциалы возникают в результате различных потенциалопределяющих реакций, то говорят о химическом гальваническом элементе, если потенциалопределяющие реакции одинаковы, то о концентрационном гальваническом элементе.
Химический гальванический элемент. Простейшим гальваниче-ским элементом является электрохимическая система, составленная из двух электродов первого рода, электролиты которых соединены ионным проводником, например: (а)(−)Zn|Zn2+||Cu2+|Cu(+)(к).
При замкнутой внешней цепи, за счет разности потенциалов электроны с анода будут перетекать на катод. Реакции, протекающие на электродах при работе приведенного ГЭ:
анод(-) А: Meа → (Me n +)а + nē (Zn→Zn2+ + 2 ē),
катод(+) К: (Me n +)к+ nē → Meк(Cu2+ + 2ē→Cu).
Разность потенциалов между катодом и анодом при отсутствии тока в цепи называется электродвижущей силой (ЭДС) гальваниче-ского элемента. ЭДС - величина положительная, измеряется в вольтах (В): E = jк – jа> 0.
Величины потенциалов катода и анода зависят от концентрации электролитов и температуры и рассчитываются по уравнению Нернста:
E = (j0к 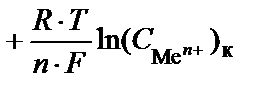 ) – (j0а
) – (j0а  ;
;
E = (j0к – j0а) + (
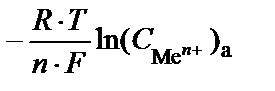 ).
).
Концентрационный гальванический элемент. Когда оба электрода электрохимической системы одинаковы по своей природе, их потенциалы образуются за счет одной и той же химической реакции, например:
(а)(−) Cu | CuSO4 || CuSO4 | Cu (+)(к).
Из уравнения Нернста следует, что потенциал электрода, кото-рый находится в контакте с электролитом большей концентрации, будет больше потенциала электрода, находящегося в контакте с электролитом меньшей концентрации. Следовательно, в таком гальва-ническом элементе анодом будет электрод, находящийся в контакте с электролитом меньшей концентрации, катодом – электрод, у которого концентрация больше 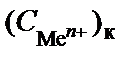 >
> 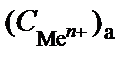 . При работе ГЭ на аноде происходит окисление металла, а на катоде – восстановление его катионов:
. При работе ГЭ на аноде происходит окисление металла, а на катоде – восстановление его катионов:
анод(-) А: Me ® Me n + + nē (Cu → Cu2++ 2 ē),
катод(+) К: Me n ++ nē ® Me(Cu2+ + 2ē → Cu).
В этом случае ЭДС определяется только разностью концентраций (активностей) ионов металла в электролите:
E = 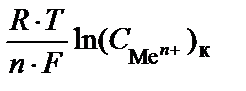
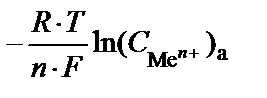 =
=  .
.
Электрохимическая коррозия. Электрохимической коррозией на-зывают процессы взаимодействия металлов с водными растворами электролитов, сопровождающиеся возникновением в системе электрического тока в результате пространственного разделения процессов окисления и восстановления. Электрохимическая коррозия металлов представляет собой самопроизвольное разрушение металлов при их взаимодействии с коррозионной средой, проводящей электрический ток, т.е. с электролитом.
При химической коррозии ее продукты образуются непосред-
ственно на участках поверхности, где происходит разрушение ме-талла.
Коррозионный процесс возникает в результате работы множества короткозамкнутых гальванических элементов (микрогальванопар), образующихся вследствие неоднородности поверхности металла или состава окружающей среды.
Поверхность корродирующего металла упрощенно можно рас-сматривать как короткозамкнутую двухэлектродную систему, состо-ящую из двух видов участков: анодных и катодных, находящихся в одном и том же электролите. За счет разности потенциалов катода и анода работа коррозионного элемента напоминает работу гальвани-ческого элемента и сопровождается перемещением электронов в металле и ионов в электролите (рис. 7).
Рис. 7
Электрохимическое растворение металла – сложный процесс, состоящий из трех основных стадий:
1) анодного процесса на анодных участках – растворения (кор-розии) металла в электролите с образованием ионов (гидратирован-ных): А: Me0 → Me n ++ ne или (А: n Me0 + m H2O → Me n +· m H2O + ne), избыточные электроны при этом остаются на поверхности металла;
2) процесса движения электронов по металлу от анодных уча-стков к катодным и перемещения катионов и анионов в растворе;
3) катодного процесса – присоединения электронов какими-либо ионами или молекулами раствора – деполяризаторами (D), спо-собными к восстановлению на катодных участках: К: D + ne → [ Dne ].
Деполяризаторами катодного процесса могут быть атомы кисло-рода, ионы водорода или другие ионы раствора. Катодная реакция определяется составом раствора в каждом конкретном случае.
Процессы коррозии металлов, в которых катодная деполяризация осуществляется растворенным в электролите кислородом, называются кислородной деполяризацией. В зависимости от среды можно выде-лить следующие катодные процессы:
а) в нейтральных и щелочных растворах (атмосферная коррозия)
К: О2 + 2Н2О + 4е → 4ОН–, φ1 = +0,80 В;
б) в кислых растворах
К: О2 + 4Н+ + 4е → 2Н2О, φ2 = +1,23 В.
Процессы коррозии металлов, в которых катодная реакция осу-ществляется ионами водорода, называют водородной деполяризацией. При водородной деполяризации корродируют металлы, соприкасаю-щиеся с растворами кислот, а также в нейтральных растворах в отсутствие растворенного кислорода.
Иногда, упрощенно, процесс восстановления ионов водорода описывают реакцией
К: 2Н+ + 2е → Н2, φ3 = 0 В
или
К: 2Н2О + 2е → Н2 + 2ОН–, φ4 = −0,41 В.
В связи с тем, что потенциал φ4 более отрицателен по сравнению с φ1 и φ2, коррозия металлов с водородной деполяризацией является термодинамически менее вероятным процессом, чем с кислородной деполяризацией.
Обычно на границе раздела «металл–электролит» существуют не-однородности поверхности металла или электролита. Это приводит к возникновению участков, на которых энергетически выгодно проте-кание либо анодного, либо катодного процессов.
Неоднородность системы «металл–электролит» и, как следствие, возникновение коррозионных гальванических элементов могут быть вызваны следующими причинами:
· контактом металлов с различной химической активностью (разные φ);
· неоднородностью металла по химическому или фазовому со-ставу (если, например, изделие состоит из деталей, изготовленных из разнородных металлов);
· наличием на поверхности окисных пленок;
· различием концентраций растворенных в электролите веществ на отдельных участках контакта металла с электролитом;
· неодинаковой температурой различных участков металла;
· механическими напряжениями в металлической детали.
Окисление атомов металла с выходом катионов в электролит и восстановление ионов или молекул среды на поверхности металла являются первичными процессами коррозии. Образовавшиеся при этом ионы Me n + (анодный процесс), OH− (катодный процесс) и растворенные в электролите вещества могут вступать в химические реакции, представляющие собой вторичные процессы (реакции). Обычно вторичные процессы приводят к образованию труднорастворимых продуктов коррозии, чаще всего гидроксидов, основных и средних солей.
 2020-10-09
2020-10-09 240
240








