Электролиты – химические соединения (вещества), распадаю-щиеся на ионы в растворах или расплавах и проводящие элект-рический ток (NaCl, HCl, KOH и т.д.).
Электролиз – это окислительно-восстановительный процесс, про-текающий на электродах при прохождении электрического тока через расплав или раствор электролита. При электролизе химическая реак-ция протекает за счет энергии электрического тока, который подво-дится от внешнего источника тока. Устройство, в котором проводят электролиз, называется электролизером или электролитической ван-ной. Электрод, на котором протекает реакция окисления, называется анодом (знак – (+)). Анод принимает электроны от анионов. Элект-род, на котором протекает реакция восстановления, называется катодом (знак – (−)). Катод отдает электроны катионам. Количество электронов, полученным анодом, равно количеству электронов, отданных катодом.
Например, если в расплав хлорида натрия погрузить инертные электроды (угольные) и пропустить электрический ток, то ионы при-обретут направленное движение: катионы Nа+ будут двигаться к катоду (отрицательно заряженный электрод), а анионы Cl− − к аноду (положительно заряженному электроду). Суммарное уравнение элект-ролиза расплава хлорида натрия:
(−) катод: Nа+ Nа+ + ē → Na,
(+) анод: Cl− 2Cl− − 2ē → Cl2,
2Nа+ + 2Сl− → 2Na + Cl2(газ).
Электролиз водных растворов электролитов является более слож-ным, так как в процессе могут участвовать молекулы воды. Поэтому при электролизе водного раствора хлорида натрия теоретически могут протекать следующие реакции:
· окисление на аноде:
2Cl− − 2ē → Сl2 или 2Н2О − 4ē = O2 + 4Н+.
· восстановление на катоде:
2Н2О + 2ē = Н2 + 2OH−.
Суммарное уравнение процесса:
2Cl− + 2Н2О → Cl2 ↑ + Н2↑+ 2OH−.
Чтобы определить, какой из возможных процессов будет про-текать, нужно помнить следующие правила для процессов восста-новления, протекающих на катоде.
1. В водных растворах, содержащих катионы металлов с боль-шим стандартным электродным потенциалом, чем у водорода (от Сu2+ до Аu3+), восстанавливаются ионы металлов.
2. Катионы металлов с потенциалом меньшим, чем у водорода, но большим, чем у алюминия (от Al3+ до H+), при электролизе на катоде восстанавливаются одновременно с молекулами воды.
3. Если же водный раствор содержит катионы различных ме-таллов, то при электролизе восстановление этих металлов на катоде протекает в порядке уменьшения алгебраической величины стандарт-ного электродного потенциала соответствующего металла.
Из смеси катионов Аg+, Сu2+, Fе2+ первыми будут восстанав-ливаться катионы серебра (Е о = + 0,80 В), затем катионы меди (Е о =
= + 0,34 В) и последними катионы железа (Е о = − 0,44 В). Характер реакций, протекающих на аноде, зависит как от присутствия молекул воды, так и от вещества, из которого сделан анод.
Если анод нерастворимый, т.е. инертный (уголь, графит, платина, золото), то в процессе электролиза сначала окисляются анионы бескислородных кислот (кроме плавиковой), затем молекулы воды (с выделением кислорода) и только в последнюю очередь – соли кислородосодержащих кислот и фторидов. При электролизе растворов щелочей идет окисление гидроксид ионов. Если используется растворимый анод (железо, медь, цинк, серебро и все металлы, окисляющиеся в процессе электролиза), то независимо от природы аниона всегда идет окисление металла анода:
Ме0 − nē → Ме n +
анод (тв.фаза) (раствор)
Качественные соотношения при электролизе были установлены Майклом Фарадеем в 1827 г.
Масса электролита, подвергшаяся химическому превращению, а также массы веществ, выделившиеся на электродах (в виде осадков или газов), прямо пропорциональны количеству протекшего через электролит электричества (заряда) и химическим эквивалентам вещества:
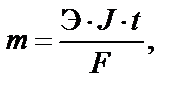 Э = М/n,
Э = М/n,
где m – масса электролита, подвергшаяся химическому превращению или масса веществ, выделившихся на электродах в виде осадков или газов, г; Э – эквивалентная масса вещества, г/моль экв; J – сила то-
ка, А; t – время электролиза, с; F – постоянная (число) Фарадея – 96500 Кл/моль экв., M – молярная (атомная) масса вещества, г/моль;
n – число электронов электродного процесса.
При прохождении одного и того же количества электричества через ряд электролитов массы веществ, восстановившихся на катоде и окислившихся на аноде, пропорциональны их химическим эквива-лентам. Эквивалентом вещества (элемента) Э называется такое его количество, которое взаимодействует с одним молем атомов водорода или с одним эквивалентом любого другого вещества (элемента).
Если J∙t = 96500 Кл, то m = Э, т.е. для химического превращения 1 экв электролита необходимо попустить через электролит 96500 Кл (1F–число Фарадея)или 26,8 А·ч (1 А·ч = 3600 Кл). Если J∙t = 1 Кл, то m = Э/ F.
 2020-10-09
2020-10-09 125
125








