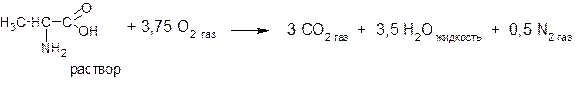1. Актуальность темы:
Все химические реакции сопровождаются выделением или поглощением теплоты, что объясняется разрывом одних химических связей в молекулах исходных веществ и образование других химических связей в молекулах продуктов реакций. Частью термодинамики является термохимия, которая изучает тепловые эффекты реакции.
Термохимические расчеты широко используют в медицине для оценки калорийности пищевых продуктов, составления диет для больных. Знание раздела термодинамики позволяет определить возможность самопроизвольного протекания реакций, направление реакций, биоэнергетику физиологических процессов в живых организмах.
Учение о скоростях протекания химических реакций (т.е. химическая кинетика) представляет для будущих врачей большой интерес, т.к. все биохимические процессы в живых клетках осуществляются с определенной скоростью и зависят от многих факторов, таких, например, как концентрация субстрата, температура.
- Цель обучения:
Знать основные понятия и законы термодинамики, кинетики, определять тепловые эффекты реакций, определять скорость и порядок реакции, проводить термохимические расчеты по определению изменения энтальпии, энтропии, энергии Гиббса, определять возможность протекания реакций.
1. Предмет и задачи термодинамики. Химическая термодинамика.Термодинамические системы, их классификация. Параметры и функции термодинамических систем.
2. Первое начало термодинамики. Внутренняя энергия. Энтальпия. Закон Гесса, следствия из него. Термохимия. Калориметрия.
3. Второе начало термодинамики. Энтропия. Направление самопроизвольного протекания реакции. Свободная энергия Гиббса, Гельмгольца.
4. Особенности живых организмов как термодинамических систем.
5. Химическая кинетика. Механизмы и скорость химических реакций. Гомогенные и гетерогенные реакции. Факторы, влияющие на скорость протекания реакции (природа реагирующих веществ, площадь поверхности, концентрация, температура, давление, энтропия активации, энергия активации, катализаторы).
6. Закон действия масс. Порядок реакции.
7. Зависимость скорости реакции от температуры. Уравнение Вант-Гоффа.
8. Катализ и катализаторы. Гомогенный и гетерогенный катализ. Понятие об обратимых и необратимых процессах.
9. Понятие о химическом равновесии. Константа химического равновесия. Принцип Ле-Шателье. Факторы смещения химического равновесия (температура, концентрация, давление).
10. Связь между изменением свободной энергией Гиббса и константой химического равновесия.
11. Проявление принципа Ле-Шателье в живых организмах (сопряженные реакции).
| № | Текст задания: |
| 1. | Рассчитать тепловой эффект реакции (ΔНº р-ции) при н.у: 4NН3(г)+5О2(г)→4NO(г)+6Н2О(ж), пользуясь справочными значениями стандартных теплот (энтальпий) образования веществ. |
| 2. | Рассчитать стандартную энтальпию реакции 2SО2(г)+О2(г)→2SО3(г). Указать, будет ли данная реакция экзо- или эндотермической. |
| 3. | Рассчитать изменение энтропии реакции при стандартных условиях: СН4(г)+2О2(г)→СО2(г)+2Н2О(ж), использовав табличные данные. |
| 4. | Возможно ли самопроизвольное протекание реакции (подтвердить расчетами): С6Н12О6 → 2 СзН6Оз Глюкоза Молочная к-та |
| 5. | Оксид азота (II) взаимодействует с хлором согласно уравнению: 2NO(г) + Cl2(г) ® 2NOCl(г). Константа скорости для этой реакции соответствует 2,2∙104 л/(моль∙с). Рассчитать скорость образования NOCl, если концентрация NO = 1,00∙10-6 моль/л, концентрация Cl2 = 0,50∙10-6 моль/л. Реакция имеет второй порядок по NO и первый порядок по Cl2. |
| 6. | При повышении температуры на 300 К скорость реакции увеличилась в 64 раза. Вычислить температурный коэффициент (γ). |
| 7. | В каком направлении сместится химическое равновесие в системе: CO2(г) + С(т) ↔ 2CO(г), ΔH = +171 кДж/моль. а)при повышении температуры? б)при повышении концентрации СО2? |
| 8. | Какой из процессов должен проводиться при высоком давлении? А)N2(г) + 3H2(г) ↔ 2NH3(г), В)CO2(г) + С(т) ↔ 2CO(г), С)Fe3O4(т) + 4H2(г) ↔ 3Fe(т) + 4H2O(г). |
| № | Эталоны ответов: |
| 1. | В соответствии с первым следствием из закона Гесса ΔНº р-ции = ∑ ΔНºобр(прод. р-ции) - ∑ ΔНº обр.(исх. в-в); ΔНº р-ции = [4 ´ ΔНº обр(NO)г + 6 ´ ΔНº обр.(Н2О)ж] – [4 ´ ΔНºобр.(NHз)г + 5 ´ ΔНºобр.(О2)г]. ΔНº р-ции = [4 ´ 91 + 6 ´ (-286) ] - [4 ´ (-46) + 5 х 0] = -1168 кДж, процесс экзотермический. |
| 2. | 2SО2(г) + О2(г) = 2SО3(г); 2 1 2 моль ΔНº = ∑ ΔНобрº (прод.) - ∑ ΔНобрº (реаг.) = [2 (-396)] - [2 (-297) + 1(0)] = -198 кДж. Стандартная энтальпия реакции равна -198 кДж. Реакция экзотермическая. |
| 3. | ΔSº = [2Sº(Н2О(ж)) + Sº(СО2 (г))] – [Sº(СН4(г)) + 2Sº(О2(г))] ΔSº = [2´70 + 213,7] – [186,3 + 2´205,0] = -242,4 Дж´К-1. |
| 4. | Необходимо рассчитать величину свободной энергии Гиббса, т.к. она является критерием самопроизвольно протекающего процесса. По таблице найти значение энергии Гиббса глюкозы и молочной кислоты. ΔGº(реакции) = ∑ ΔGобрº(продуктов реакции) - ∑ ΔGобрº(исходных веществ) ΔGº(реакции) =[2´ (-539)] - [-917]= -161 кДж. Реакция может протекать самопроизвольно в стандартных условиях, т.к.ΔG < 0. |
| 5. | Кинетическое выражение скорости для реакции 2NO (г) + Cl2 (г) ® 2NOCl (г) = 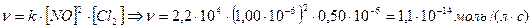 . . |
| 6. | Используя формулу  , где υT2 – скорость реакции при Т2, υT1 – скорость реакции при Т1, γ – температурный коэффициент (предел от 2-4), рассчитать, что , где υT2 – скорость реакции при Т2, υT1 – скорость реакции при Т1, γ – температурный коэффициент (предел от 2-4), рассчитать, что 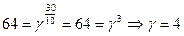 |
| 7. | а)Тепловой эффект реакции, ΔHр > 0, процесс эндотермический. По принципу Ле-Шателье, при повышении температуры, равновесие в системе смещается в сторону эндотермической реакции, следовательно, при повышении температуры в системе CO2(г) + С(т) ↔ 2CO(г), равновесие сместится в сторону выхода СО (продукт реакции). Б)По принципу Ле-Шателье, при увеличении концентрации одного из реагентов, равновесие в системе смещается в сторону расхода этого реагента, следовательно, равновесие сместится в сторону продуктов реакции (выход угарного газа). |
| 8. | По принципу Ле-Шателье, при повышении давления, равновесие в системе смещается в сторону меньшего объема газов, следовательно, в реакции А при повышении давления равновесие сместится в сторону образования аммиака (объем газа = 2), в реакции Б – в сторону образования СО2 (исходные вещества), в реакции В равновесие системы не сместится (равные объемы газовой фазы). |
- Выполнить тестовые задания (письменно):
| 1. | Стандартные термодинамические величины характеризуют состояние системы при следующих значениях температуры и давления: | |
| А | t = 0oС, p =1 атм | |
| Б | t =20oС, p = 101,3 кПа | |
| В | Т = 298оК, p = 101,3 кПа | |
| Г | Т = 273оК, p = 101,3 кПа | |
| 2. | Термодинамическая система называется «закрытой», если с внешней средой она… | |
| А | обменивается веществом только после обмена энергией. | |
| Б | обменивается энергией, не обменивается веществом. | |
| В | не обменивается ни веществом, ни энергией. | |
| Г | не обменивается веществами, содержащими углерод. | |
| 3. | Какая из формул является математическим выражением закона Гесса: | |
| А | ΔН (реак.) = ΔH1 + ΔН2 + ΔН3 | |
| Б | Δ Н (реак.) = ∑ΔН(обр. кон. в-в.) - ∑ΔН(обр. исх. в-в.) | |
| В | ΔН(реак.) = ΔG + ТΔS | |
| Г | ΔН(реак.) = ΔG - ТΔS | |
| 4. | Какая из формул относится к первому следствию из закона Гесса: | |
| А | ΔН (реак.) = ΔH1 + ΔН2 + ΔН3 | |
| Б | Δ Н (реак.) = ∑ΔНобр (кон. в-в.) - ∑ΔНобр (исх. в-в.) | |
| В | ΔН(реак.) = ΔG + ТΔS | |
| Г | ΔН(реак.) = ΔG-ТΔS | |
| 5. | Энтальпия системы является мерой её: | |
| А | Обратимости | |
| Б | Неупорядоченности | |
| В | Теплосодержания | |
| Г | Упорядоченности | |
| 6. | Энтропия системы является мерой её: | |
| А | Обратимости | |
| Б | Неупорядоченности | |
| В | Теплосодержания | |
| Г | Теплового эффекта | |
| 7. | В эндотермической реакции... | |
| А | Энтальпия реакционной системы повышается (ΔН > 0) | |
| Б | Энтропия реакционной системы уменьшается (S < 0) | |
| В | Энтальпия реакционной системы уменьшается (ΔН < 0) | |
| Г | Давление реакционной системы повышается | |
| 8. | Использование оксида магния в пломбировочных материалах основано на экзотермической реакции: 3MgO + 2H3PO4 → Mg3(PO4)2 + 3H2O В результате протекания процесса энтальпия и энергия Гиббса … | |
| А | ΔН > 0; ΔG = 0 | |
| Б | ΔН < 0; ΔG > 0 | |
| В | ΔН > 0; ΔG < 0 | |
| Г | ΔН = 0; ΔG < 0 | |
| 9. | В каких процессах ΔS0 < 0? | |
| А | 2СО (г) + О2 (г) = 2СО2 (г) | |
| Б | Н2 (г) + Сl2 (г) = 2HCl (г) | |
| В | NН4NO2 (т) = 2H2О (г) + N2 (г) | |
| Г | 2Н2S (г) + 3О2 (г) = 2H2O (г) + 2SО2 (г) | |
| 10. | Скорость химической реакции - это: | |
| А | время, за которое полностью расходуется одно из исходных веществ | |
| Б | время, за которое заканчивается реакция | |
| В | количества вещества, реагирующего за единицу времени в единице объема | |
| Г | количество вещества продуктов реакции к моменту окончания реакции | |
| 11. | Единицами измерения скорости химической реакции являются: | |
| А | л/(моль·сек) | |
| Б | моль/л | |
| В | л/моль | |
| Г | моль/(л·сек) | |
| 12. | В некоторый момент для обратимой реакции, протекающей в организме: АДФ + Н3РО4 = АТФ + Н2О изменение энергии Гиббса становится равным нулю. Сопоставьте скорости прямой и обратной реакции в этот момент. | |
| А | скорость прямой реакции больше | |
| Б | скорости прямой и обратной реакций одинаковы | |
| В | скорость обратной реакции больше | |
| Г | данных недостаточно | |
| 13. | Общий порядок реакции в кинетическом уравнении υ = k [CO] [H2]2 равняется: | |
| А | 0 | |
| Б | 1 | |
| В | 2 | |
| Г | 3 | |
| 14. | Кинетическое уравнение реакции υ = k [A]2 [B]. Указать во сколько раз уменьшится скорость химической реакции при уменьшении концентрации реагирующих веществ в три раза | |
| А | 27 | |
| Б | 6 | |
| В | 9 | |
| Г | 16 | |
| 15. | Указать во сколько раз возрастает скорость химической реакции при повышении температуры на 10оС | |
| А | в 5 раз | |
| Б | в 2-4 раза | |
| В | в 5-6 раз | |
| Г | в 0,1-0,5 раз | |
| 16. | Катализатор увеличивает скорость химической реакции, потому что: | |
| А | Уменьшает энергию активации | |
| Б | Увеличивает энергию активации | |
| В | Не влияет на энергию активации | |
| Г | Сначала увеличивает, а потом уменьшает энергию активации | |
| 17. | В каком направлении сместится химическое равновесие в системе CO2 (г) + С (т) ↔ 2CO (г) ΔH= +171 кДж/моль при понижении температуры? | |
| А | Вправо | |
| Б | Влево | |
| В | Не сместится | |
| 18. | В какую сторону сместится равновесие в системе H2 + Cl2 ↔ 2HCl ΔH = -91,8 кДж/моль при повышении температуры? | |
| А | Вправо | |
| Б | Влево | |
| В | Не сместится | |
| 19. | В какую сторону сместится химическое равновесие в системе CuO (т) + H2 (г) ↔ Cu (т) + H2O (г) при понижении давления? | |
| А | В сторону исходных веществ | |
| Б | В сторону продуктов реакции | |
| В | Не сместится | |
| 20. | Какая из записей константы химического равновесия будет верной для реакции СО(г) + 2Н2 (г) ↔ СН3ОН (г): | |
| А |  | |
| Б | 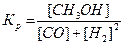 | |
| В | 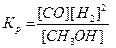 |
- Задачи для самостоятельного решения (выполнить письменно):
| 1. | Предельное окисление L-аланина в организме может происходить в соответствии с уравнением:
Считая условия протекания реакции близкими к стандартным, определите изменение энтальпии (ΔН0р-и) данного процесса, если известно, что ΔH0обр.(CO2 г) = -393,8 кДж/моль, ΔН0обр.[С3Н7О2N РАСТВОР] = -563 кДж/моль, ΔН0обр.(Н2O ж) = - 286 кДж/моль. | |
| 2. | На основании термодинамических расчётов указать, что оксид азота (I), который используется в анестезиологии, не может окисляться до ядовитых оксидов азота – NO, N2O3 по схемам: а) 2N2O + O2 → 4NO, б) N2O + O2 → N2O3, если ΔGºобр (N2О) = 104,1 кДж/моль, ΔGº обр (О2) = 0 кДж/моль, ΔGºобр (NO) = 86,6 кДж/моль, ΔGº обр (N2O3) = 140,5 кДж/моль. | |
| 3. | Во сколько раз изменится скорость химической реакции 2SO2 + O2 = 2SO3, если концентрацию исходных веществ увеличить в 4 раза? | |
| 4. | Температурный коэффициент равен 2. На сколько градусов нужно охладить смесь, чтобы скорость реакции уменьшить в 8 раз? | |
| 5. | В каком направлении сместится равновесие в системе: А) 2СO + O2 = 2СO2, ΔH = -566 кДж\моль Б) N2 + O2 = 2NO, ΔH = 180 кДж\моль при понижении давления, при повышении температуры? | |
| 6. | Как повлияет на равновесие следующих реакций: А) 2Н2 + О2 = 2Н2О, ΔH = -483,6 кДж\моль Б) СаСО3 (т) = СаО (т) + СО2 (г), ΔH = 179 кДж\моль повышение давления, понижение температуры? | |
| 7. | Указать, какими изменениями концентраций реагирующих веществ можно сместить вправо равновесие реакции СO2 (г) + С (графит) = 2СO (г) | |
Лабораторная работа №1: „Зависимость скорости химической реакции от концентрации реагирующих веществ”.
Химическая реакция протекает по уравнению: Na2S2O3 + H2SO4 → Na2SO4 + S + SO2 + H2O
Как видно из уравнения реакции, разложение тиосульфата в кислой среде сопровождается выделением серы (раствор мутнеет) и выделением газа (специфический запах). Время от начала опыта до достижения определенной степени помутнения раствора можно принять за время прохождения реакции.
Ход работы:
1. В три стаканчика налить раствор тиосульфата натрия и дистиллированную воду, в количествах, указанных в таблице ниже.
2. В каждый из стаканчиков добавить при помешивании раствор серной кислоты. В каждом случае зафиксировать время от начала добавления серной кислоты до появления мутности, результаты отразить в таблице.
| № опыта | V (Na2S2O3) мл | V (H2O) мл | V (H2SO4) мл | Время появления мутности (с) | Скорость (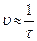 ), c-1 ), c-1 |
| 1. | 5 | 10 | 5 | ||
| 2. | 10 | 5 | 5 | ||
| 3. | 15 | 0 | 5 |
3. Сделать вывод о влиянии концентрации Na2S2O3 на скорость реакции. Предположить порядок данной реакции по тиосульфату натрия.
4. В три стаканчика налить раствор серной кислоты и дистиллированную воду, в количествах, указанных в таблице ниже.
5. В каждый из стаканчиков добавить при помешивании раствор тиосульфата натрия. В каждом случае зафиксировать время от начала добавления Na2S2O3 до появления мутности, результаты отразить в таблице.
| № опыта | V (H2SO4) мл | V (H2O) мл | V (Na2S2O3) мл | Время появления мутности (с) | Скорость (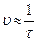 ), c-1 ), c-1 |
| 1. | 5 | 10 | 5 | ||
| 2. | 10 | 5 | 5 | ||
| 3. | 15 | 0 | 5 |
6. Сделать вывод о влиянии концентрации серной кислоты на скорость реакции. Предположить порядок данной реакции по серной кислоте.
7. Сделать суммарный вывод.
 2020-10-10
2020-10-10 1101
1101