Виды гибридизации электронных облаков
Гибридизация АО – это выравнивание валентных АО по форме и энергии в процессе образования химической связи.
1. В гибридизации могут участвовать только те АО, энергия которых достаточно близка (например, 2s- и 2р-атомные орбитали).
2. В гибридизации могут участвовать вакантные (свободные) АО, орбитали с неспаренными электронами и неподеленными электронными парами.
3. В результате гибридизации появляются новые гибридные орбитали, которые ориентируются в пространстве таким образом, чтобы после их перекрывания с орбиталями других атомов электронные пары оказались максимально удаленными друг от друга. Такое состояние молекулы отвечает минимуму энергии в силу максимального отталкивания одноименно заряженных электронов.
4. Вид гибридизации (число АО, подвергающихся гибридизации), определяется числом "атакующих" данный атом атомов и числом неподеленных электронных пар в данном атоме.
Например, в молекуле аммиака NH3 атом азота "атакуют" 3 атома водорода, кроме того, атом азота имеет 1 неподеленную пару электронов. В связи с этим число гибридных АО у атома азота равно (3 + 1) = 4, соответственно вид гибридизации – sp3.
АО, не имеющие электронов в основном состоянии атома либо ставшие вакантными при перераспределении электронов в процессе образования молекулы, могут не участвовать в гибридизации, если для них не хватает "атакующих" атомов (для образования s-связей). Такие АО частично или полностью включаются в образование p-связей.
Например, атом С может быть в состоянии sp-, sp2- и sp3-гибридизации.
1. sp-гибридизация. Такой вид гибридизации характерен для атомов элементов 2-ой группы периодической системы в молекулах типа ЭХ2 (например, в молекулах галогенидов бериллия, цинка, кадмия и ртути), а также для атома С в молекулах алкинов (при тройной связи), карбина, СО2.
Пример. ВеF2. В момент образования связи происходит перестройка АО атома Ве, переходящего в возбужденное состояние: Ве 1s22s2 ® Ве* 1s22s12p1.
Гибридные АО располагаются под углом 180о. Благодаря такому виду гибридизации обе связи являются одинаковыми и молекула имеет линейное строение: F–Be–F.
2. sp2-гибридизация. Такой вид гибридизации характерен для атомов элементов 3-ей группы периодической системы в молекулах типа ЭХ3 (например, в соединениях бора – галогенидах, борной кислоте, триметилборе), а также для атома С в графите, молекулах алкенов, алкадиенов (при двойных связях), бензола.
Пример. ВF3. В момент образования связи происходит перестройка АО атома В, переходящего в возбужденное состояние: В 1s22s22p1 ® B* 1s22s12p2.
Гибридные АО располагаются под углом 120о. Молекула имеет форму правильного треугольника (плоская, треугольная):

3. sp3-гибридизация. Такой вид гибридизации характерен для атомов 4-ой группы (например, углерода, кремния, германия) в молекулах типа ЭХ4, а также для атома С в алмазе, молекулах алканов, для атома N в молекуле NH3, NH4+, атома О в молекуле Н2О и т.д.
Пример 1. СН4. В момент образования связи происходит перестройка АО атома С, переходящего в возбужденное состояние: С 1s22s22p2 ® С* 1s22s12p3.
Гибридные АО располагаются под углом 109о28'.
Молекула имеет форму тетраэдра:
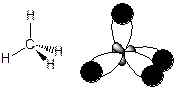
Пример 2. NН3 и NН4+.
Электронная структура атома N: 1s22s22p3. Гибридизации подвергаются 3 АО, содержащие неспаренные электроны, и 1 АО, содержащая неподеленную электронную пару. В силу более сильного отталкивания неподеленной электронной пары от электронных пар s-связей угол связи в молекуле аммиака составляет 107,3о (ближе к тетраэдрическому, а не к прямому).
Молекула имеет форму тригональной пирамиды:
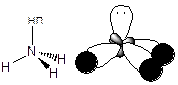
Представления об sp3-гибридизации позволяют объяснить возможность образования иона аммония и равноценность связей в нем.
Пример 3. Н2О.
Электронная структура атома О 1s22s22p4. Гибридизации подвергаются 2 АО, содержащие неспаренные электроны, и 2 АО, содержащие неподеленные электронные пары. Угол связи в молекуле воды составляет 104,5о (также ближе к тетраэдрическому, а не к прямому).
Молекула имеет угловую форму:

Представления об sp3-гибридизации позволяют объяснить возможность образования иона оксония (гидроксония) и образование каждой молекулой 4-х водородных связей в структуре льда.
4. sp3d-гибридизация. Такой вид гибридизации характерен для атомов элементов 5-ой группы (начиная с Р) в молекулах типа ЭХ5.
Пример. РСl5. Электронная структура атома Р в основном и возбужденном состояниях: Р 1s22s22p63s23p3 ® P* 1s22s22p63s13p33d1. Форма молекулы – гексаэдр (точнее – тригональная бипирамида):
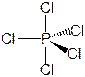
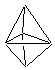
5. sp3d2-гибридизация. Такой вид гибридизации характерен для атомов элементов 6-ой группы (начиная с S) в молекулах типа ЭХ6.
Пример. SF6. Электронная структура атома S в основном и возбужденном состояниях: S 1s22s22p63s23p4 ® P* 1s22s22p63s13p33d2.
Форма молекулы – октаэдр:
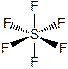
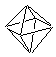
6. sp3d3-гибридизация. Такой вид гибридизации характерен для атомов элементов 7 группы (начиная с Cl) в молекулах типа ЭХ7.
Пример. IF7. Электронная структура атома F в основном и возбужденном состояниях: I 5s23p5 ® I* 5s13p33d3. Форма молекулы – декаэдр (точнее – пентагональная бипирамида):
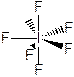
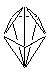
7. sp3d4-гибридизация. Такой вид гибридизации характерен для атомов элементов 8 группы (кроме Не и Ne) в молекулах типа ЭХ8.
Пример. ХеF8. Электронная структура атома Хе в основном и возбужденном состояниях: Хе 5s23p6 ® Хе* 5s13p33d4.
Форма молекулы – додекаэдр:
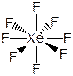
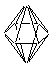
Могут быть и другие виды гибридизации АО.
 2014-02-05
2014-02-05 21431
21431