ВАКТА - Цельновирионная вакцина против вирусного гепатита А
Применяется для профилактики вирусного гепатита А у взрослых и детей старше 2 лет. Препарат получен путем культивирования вируса в диплоидных клетках фибробластов человека MRS-5 с последующей его очисткой, инактивацией формалином и адсорбции на гидроксиде алюминия.
Курс иммунизации состоит из 2 прививок – вакцинации и ревакцинации.
После вакцинации иммунитет развивается через 14 дней у 95-97 % привитых лиц. Ревакцинация обеспечивает сохранение иммунитета в течение 6 лет (на весь период наблюдения).
Препарат следует хранить при температуре от 2 до 8 °С. Вакцину нельзя замораживать, т.к. это приводит к потере ее эффективности.
Срок годности вакцины – 3 года.
«Геп-А-ин-ВАК» – вакцина против гепатита А культуральная очищенная концентрированная адсорбированная инактивированная жидкая
Вакцина применяется для профилактики гепатита А у детей с трехлетнего возраста, подростков и взрослых. Препарат представляет собой суспензию вирионов гепатита А (штамм ЛБА-86), выращенных на культуре перевиваемых клеток 4647, очищенных, концентрированных инактивированных и адсорбированных на алюминия гидроксиде. В одном миллилитре вакцины содержится 50 ИФА единиц (25 нг) антигена вируса гепатита А; антибиотики и консерванты отсутствуют. Бесцветная прозрачная или слегка опалесцирующая жидкость с белым осадком, при встряхивании гомогенная быстрооседающая взвесь белого цвета без хлопьев и посторонних включений.
Разовая доза для детей и подростков до 17 лет включительно составляет 0,5 мл, для взрослых 1,0 мл. Полный курс вакцинации состоит из двух прививок, проводимых с интервалом 6-12 месяцев и обеспечивает длительную защиту от заражения гепатитом А. В отдельных случаях (по эпидпоказаниям) возможно однократное введение вакцины, обеспечивающее защиту от инфекции сроком до 12 месяцев.
Вакцина выпускается в ампулах, содержащих по 0,5 мл (1 доза для детей), 1,0 мл (1 доза для взрослых или 2 дозы для детей) и 2,0 мл (2 дозы для взрослых или 4 дозы для детей). Упаковка содержит 10 ампул.
Вакцину хранят и транспортируют при температуре от 2 до 8 °С.
Срок годности вакцины – 1,5 года.
Хаврикс - вакцина инактивированная против гепатита А
Вакцина против гепатита А «Хаврикс» представляет собой стерильную суспензию, содержащую вирус гепатита А (штамм НМ 175 вируса гепатита А), инактивированный формальдегидом и адсорбированный на алюминия гидроксиде.
Вакцина содержит неопределяемые следы антибиотика неомицина. Вирус культивирован в диплоидных клетках человека МRS 5. Перед выделением вируса клетки тщательно промывают для удаления компонентов культуральной среды. Затем путем лизиса клеток готовят вирусную суспензию с последующей очисткой методами ультрафильтрации и гель-хроматографии. Вакцина отвечает всем требованиям Всемирной организации здравоохранения в отношении инактивированных вакцин для профилактики вирусного гепатита А.
Вакцина «Хаврикс» (для взрослых) стандартизована по содержанию вирусного антигена, которое составляет 1440 иммуноферментных единиц (ELISA) в одной дозе вакцины объемом 1,0 мл.
Вакцина «Хаврикс» (для детей) стандартизована по содержанию вирусного антигена, которое составляет 720 иммуноферментных единиц (ELISA) в одной дозе вакцины объемом 0,5 мл.
Вакцина должна храниться при температуре 2 до 8 °С.
Срок годности – 3 года.
ГЛАВА 3. КАЛИЦИВИРУСЫ (СЕМ. CALICIVIRIDAE)
Название семейства происходит от лат. calix – кубок, который напоминают углубления на поверхности вириона. Семейство Caliciviridae включает 4 рода: Lagovirus, Norovirus, Sapovirus и Vesivirus. Из них только Norovirus (по названию протипного вируса Норфолк) и Sapovirus (по названию прототипного вируса Саппоро) имеют значение в патологии человека.
Структура. Вирион безоболочечный; имеет икосаэдрический капсид с 32 чашеобразными углублениями (ямками). Форма – сферическая (диаметр 27-38 нм) с неровным профилем. На поверхности вириона различают 10 выступов, сформированных краями чашеобразных углублений (рис. 38). Вирионы имеют один главный полипептид и два минорных белка. Геном – линейная, однонитевая плюс-РНК, с которой ковалентно связан небольшой полипептид (VPg).

Рис. 38. Строение калицивируса.
Репродукция и сборка вирионов происходит в цитоплазме. Сначала синтезируется с помощью вирусной полимеразы комплементарная цепь минус-РНК, затем на ее основе создается вирусная плюс-РНК. Выход вирионов осуществляется при лизисе клеток.
Культивирование в культурах клеток и в организме лабораторных животных не приносит результатов.
Антигенные свойства малоизучены.
Резистентность. Вирусы обладают высоким уровнем устойчивости в окружающей среде и могут сохранять инфицирующие свойства в течение нескольких лет.
Этиология. Норовирусные и саповирусные инфекции по частоте занимают 2-е (после ротавирусных) место среди острых кишечных инфекций человека. Вирусы Норфолк были впервые обнаружены в городе Норфолк, СШа в 1972 году.
Эпидемиология. Норо- и саповирусы накапливаются в морепродуктах (устрицы), ягодах, овощах, птице и мясных продуктах. Механизм передачи вируса фекально-оральный. Реализуется также контактно-бытовой, пищевой и водный пути передачи возбудителя. Возникновение массовых вспышек возможно из-за загрязнения и накопления вируса в источниках питьевой воды.
Норовирусная инфекция возникает во всех возрастных группах, но чаще (80 %) болеют дети. Сезонность осенне-зимняя.
Патогенез изучен только при экспериментальной инфекции у добровольцев. Поражаются преимущественно проксимальные отделы тонкой кишки (двенадцатиперстной, реже – тощей и тонкой). Норо- и саповирусы размножаются в зрелых столбчатых эпителиоцитах кишечных ворсинок, вызывают гибель абсорбционных клеток и секрецию жидкости клетками кишечных желез. Преобладание секретирующих процессов над абсорбционными приводит к развитию диареи. Отмечается снижение ферментативной активности клеток щеточной каемки и развитие вторичной дисахаридазной недостаточности.
Клиническая картина. Инкубационный период составляет от 12 до 24 часов, нередко длится 48 часов. Клиническая картина характеризуется триадой симптомов: лихорадка, рвота, диарея.
Начало заболевания острое, лихорадка непродолжительная, интоксикация слабая, рвота повторная (от 3 до 5 раз). Ведущим в клинике является диарейный синдром. Стул появляется к концу первых суток, носит водянистый характер, иногда с примесью слизи, без запаха. Частота стула от 2 до 10 раз в сутки. Особенностью течения норовирусного гастроэнтерита у детей первого года жизни является отсутствие лихорадочной реакции.
Иммунитет. После болезни организм вырабатывает иммунитет к вирусу, но на очень короткий период, около 8 недель.
Диагностика. Разработана отечественная ПЦР-диагностика для обнаружения РНК в копрофильтратах, с успехом применяется ПЦР в реальном времени. Для детекции антител в сыворотке крови используется ИФА.
Лечение патогенетическое, включает диетотерапию, регидратационную и иммунотерапию (с помощью комплексного иммуноглобулинового препарата).
Профилактика. Неспецифическая профилактика включает общие гигиенические меры. Специфической профилактики нет.
ГЛАВА 4. ГЕПАТИТ Е-ПОДОБНЫЕ ВИРУСЫ (СЕМ. HEPEVIRIDAE)
Название семейства происходит от англ. hepatitis Е-like viruses – вирусы, подобные вирусу гепатита Е.
Вирус гепатита Е является РНК-содержащим вирусом и относится к семейству Hepeviridae и одноименному роду Hepevirus (до 1 января 2002 года род Hepevirus относился к семейству Caliciviridae).
Известно 4 генотипа вируса гепатита Е человека. Предполагают, что естественный резервуар вирусов гепатита Е находится в дикой природе. Вирусы циркулируют в популяциях свиней, а антитела против них обнаружены у многих видов сельскохозяйственных животных, птиц и грызунов.
Структура. Вирион гепевирусов диаметром 27-34 нм лишен оболочки, основным его компонентом является капсидный белок, а также – в меньших количествах – небольшой иммунореактивный белок. Геном представлен одноцепочечной РНК позитивной полярности.
Этиология. Особая роль по выяснению этиологии гепатита Е принадлежит М.С. Балаяну, имевшему в крови в высоком титре антитела к гепатиту А и показавшему в 1981 году в опыте самозаражения экстрактами фекалий 9 больных гепатитом ни А, ни В возникновение желтушной формы гепатита Е.
Эпидемиология. Заражение происходит чаще через загрязненную испражнениями воду. Масоовые вспышки встречаются в основном в регионах с жарким климатом и низким санитарно-гигиеническим уровнем и связаны с отсутствием централизованного водоснабжения и канализации. Поражаются преимущественно лица молодого и среднего возраста (16-40 лет).
Клиническая картина. Инкубационный период составляет в среднем 30 дней. Болезнь протекает в легкой форме, острый период заканчивается выздоровлением, развития хронических форм не наблюдается. Соотношение желтушных и безжелтушных форм 1:10 – 1:25. Наиболее тяжело гепатит Е протекает у беременных женщин (особенно в третьем триместре беременности), развивается геморрагический синдром с обильными маточными и желудочными кровотечениями. Часто наблюдается гибель плода.
Заболевание протекает тяжелее и при ко- и суперинфекции у носителей гепатита В.
Диагностика. Специфическая диагностика основана на обнаружении РНК возбудителя с помощью ОТ-ПЦР, а также выявлении антител методом ИФА.
Лечение симптоматическое.
Профилактика должна быть направлена на улучшение санитарно-гигиенических условий и снабжения качественной питьевой водой. Для профилактики среди беременных женщин используется специфический иммуноглобулин, приготовленный из крови доноров, а также лиц, перенесших инфекцию. Созданы и выпускаются эффективные убитые цельновирионные вакцины, разрабатываются рекомбинантные живые вакцины.
ГЛАВА 5. АСТРОВИРУСЫ (СЕМ. ASTROVIRIDAE)
Название семейства происходит от греч. astron – звезда, которую напоминают вирионы на фотографиях, полученных с помощью электронной микроскопии (рис. 39). До 1 января 2002 года астровирусы относили к семейству Caliciviridae.
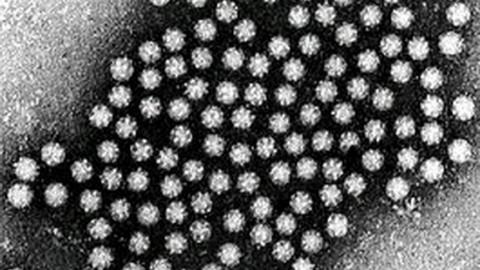
Рис. 39. ЭМ-фотография (негативное контрастирование) вирионов в испражнениях.
Семейство Astroviridae включает 2 рода: Avasrovirus, инфицирующие птиц и Mamastrovirus (от лат. mamma – молочная железа), инфицирующие млекопитающих.
Астровирусы были обнаружены в 1975 г. при электронно-микроскопическом исследовании испражнений 120 детей в возрасте до 2-х лет, страдающих гастроэнтеритом.
Структура. Вирионы астровирусов имеют сферическую форму (28-30 нм; в клеточных культурах – до 40 нм), лишены оболочки и имеют звездчатую поверхность. Нуклеокапсид имеет икосаэдрическую симметрию и состоит из трех капсидных белков.
Геном представлен однонитевой РНК позитивной полярности, фланкируемой с обоих концов нетранслируемыми последовательностями.
Репродукция. Вирионная РНК (вРНК) астровирусов является инфекционной и после проникновения вириона в клетку-мишень служит в качестве матрицы для трансляции двух неструктурных белков.
Репликация генома астровирусов происходит путем синтеза полноразмерной минус-цепи РНК, которая служит матрицей для синтеза дочерних вРНК и субгеномной иРНК, служащей открытой рамкой считывания для предшественника структурных белков (VP90). Последний протеолитически расщепляется до VP70, который включается в вирусную частицу. Созревание вирусной частицы и приобретение ею инфекционности требует дальнейшего расщепления VP70.
Культивирование. Астровирусы с трудом культивируются в культурах клеток человека и обезьян без цитопатического эффекта. Астровируы способны к размножению в клетках почек эмбриона человека в присутствии трипсина.
Антигенные свойства малоизучены.
Резистентность. Вирусы обладают высоким уровнем устойчивости в окружающей среде, особенно в воде.
Этиология. Вирусы семейства Astroviridae, рода Mamastrovirus способны вызывать гастроэнтериты людей. На сегодняшний день идентифицировано 8 серотипов астровирусов, из которых только один серотип (HAstV-1) имеет существенное значение в развитии патологии человека.
Эпидемиология. Астровирусы встречаются повсеместно во всем мире, вызывая диарею в основном у детей, и также и у пожилых людей и лиц со сниженным иммунитетом. Передача вируса происходит через зараженную пищу, воду и различные загрязнения. Вклад астровирусов в заболевание диареей варьирует от 2,5 % до 10 %, в зависимости от возраста детей.
Патогенез сходен с патогенезом ротавирусной инфекции.
Клиническая картина. Инкубационный период при астровирусных гастроэнтеритах составляет 1-2 дня. Достаточно часто, даже при установленном инфицировании и обнаружении астровирусов в стуле, у детей отсутствуют клинические признаки заболевания, что свидетельствует о превалировании бессимптомных форм инфекции.
Клинически развитие болезни напоминает ротавирусную инфекцию, хотя протекает более легко с превалированием водянистой диареи.
В последние годы все чаще стали обращать внимание на возрастающее значение астровирусов в развитии диарей у лиц с иммунодефицитами, включая ВИЧ-инфекцию, а также при нозокомиальных инфекциях.
Иммунитет кратковременный, после перенесенного заболевания. Около 65 % детей в возрасте 3-4 лет и 87 % детей 5-10 лет имеют антитела.
Диагностика. Электронная микроскопия, ИФА, иммунофлуоресценция, ПЦР позволяют выявить вирусные частицы, антигены или нуклеиновые кислоты в фекалиях инфицированных людей.
Метод ПЦР в реальном времени позволяет обнаружить все генотипы астровирусов человека.
Лечение симптоматическое.
Профилактика должна быть направлена на улучшение санитарно-гигиенических условий и снабжения качественной питьевой водой.
ГЛАВА 6. КОРОНАВИРУСЫ (СЕМ. CORONAVIRIDAE)
Название семейства происходит от лат. corona – корона, поскольку пепломеры представителей рода Coronavirus создают вокруг оболочки вириона на ЭМ-фотографиях с негативным контрастированием выраженное обрамление, подобное зубцам короны (рис. 40).
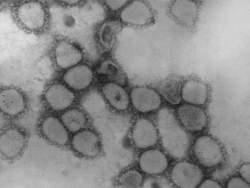
Рис. 40. ЭМ-фотография (негативное контрастирование) коронавирусов.
Семейство Coronaviridae включает два рода: Coronavirus (номинативный род) и Torovirus (от лат. torus – тор, форму которого имеет нуклекапсид представителей этого рода).
Коронавирус человека впервые был выделен Д. Тайреллом и М. Бино в 1956 г. от больных ОРВИ. Коронавирусы вызывают поражения органов дыхания (в том числе желудочно-кишечного тракта, нервной системы). Четыре из пяти известных в настоящее время штаммов – 229Е, NL63, ОС43, NKU1 – вызывают заболевания у человека.
Структура. Коронавирусы (рис. 41) имеют размер 80-220 нм. Вирион имеет оболочку, в которую встроены два гликопротеина: Е21 (трансмембранный, матриксный гликопротеин) и Е2 (пепломер). Матриксный гликопротеин Е1 пронизывает оболочку и взаимодействует с нуклеокапсидом внутри вирусной частицы; он участвует в слиянии оболочки вируса с клеточной мембраной. Некоторые штаммы имеют также третий гликопротеин – Е3 (гемагглютинин-нейраминидазу).
Нуклеокапсид вируса – это протяженная, гибкая спираль, состоящая из геномной плюс-нити РНК и большого количества молекул нуклекапсидного белка N. Вирусный геном – однонитевая плюс-РНК. Вирус имеет самый большой геном из РНК-содержащих вирусов.
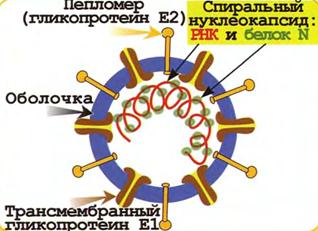
Рис. 41. Строение коронавируса.
Репродукция. Коронавирусы присоединяются к клетке (рис. 42, 1) при помощи пепломеров (гликопротеина Е2) и проникают в клетку – при слиянии вирусной оболочки с плазматической мембраной или посредством эндоцитоза (рис. 42, 2).
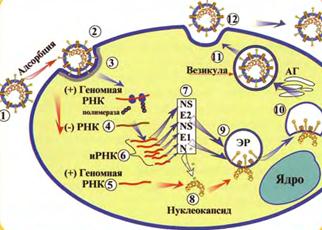
Рис. 42. Репродукция коронавирусов.
Геномная РНК связывается с рибосомами и служит в качестве иРНК при синтезе РНК-зависимой РНК-полимеразы (рис. 42, 3), которая затем считывает геномную РНК, синтезируя минус-нить полной длины (рис. 42, 4). При считывании минус-нити образуется новая геномная плюс-РНК (рис. 42, 5) и набор из 5-7 субгеномных иРНК (рис. 42, 6). При трансляции каждой субгеномной иРНК образуется один белок (рис. 42, 7). Белок N связывается в цитоплазме с геномной РНК, в результате чего образуется спиральный нуклеокапсид (рис. 42, 8). Гликопротеины Е1, Е2 переносятся (рис. 42, 9, 10) в эндоплазматический ретикулум и аппарат Гольджи. Нуклеокапсид почкуется через мембраны внутрь шероховатого эндоплазматического ретикулума, содержащего вирусные гликопротеины Е1, Е2 (рис. 42, 10). Вирионы транспортируются в везикулах к клеточной мембране (рис. 42, 11) и выходят из клетки путем экзоцитоза (рис. 42, 12).
Культивирование. Коронавирусы репродуцируются в цитоплазме клеток человека и животных – их естественных хозяев. Возможно использование культур клеток эмбриона человека и первичных эпителиальных клеток. Оптимальная температура культивирования 33-35 °С. Внутриклеточные включения не образуются.
Антигенные свойства. С геномом вируса связан основной фосфопротеин N, формирующий нуклеокапсидную структуру. В мембране обнаруживаются мультимембранный протеин М и гликопротеин S, в оболочке – протеин Е. У некоторых коронавирусов отмечается наличие гемагглютининэстеразы. Гликопротеин S – сигнальный протективный антиген при SARS, является индуктором вируснейтрализующих антител. При попадании коронавирусов в организм вырабатываются агглютинирующие, преципитирующие антитела.
Резистентность. Вирусы относительно устойчивы, во внешней среде сохраняются до 3 ч, в моче и фекалиях – до 2 суток, чувствительны к нагреванию, действию жирорастворителей, детергентов, формальдегида, окислителей.
Этиология коронавирусной инфекции. На основании генетических и антигенных свойств все известные коронавирусы разделены на три группы. К первой принадлежат коронавирусы человека 229Е, кошек, собак, гастроэнтерита свиней; ко второй – коронавирусы человека ОС43, гепатита мышей и крупного рогатого скота; в третью входят кишечные коронавирусы человека и вирусы инфекционного бронхита кур.
Эпидемиология. Коронавирусы вызывают у человека заболевания дыхательных путей, в том числе бронхиолит и пневмонию, а также диарейный синдром и, возможно, поражения нервной системы. В структуре ОРВИ коронавирусная инфекция составляет около 13 %.
Коронавирусная инфекция регистрируется в течение всего года, подъем заболеваемости зимой и ранней весной, когда эпидемическая значимость ее колеблется от 15 до 35 %. Дети болеют чаще. Инфекция распространяется воздушно-капельным, фекально-оральным и контактным путем. Источником инфекции являются больные с клинически выраженной или стертой формой заболевания.
В ноябре 2002 г. в провинции Гуандун (КНР) было выявлено и описано ранее неизвестное заболевание – тяжелый острый респираторный синдром (ТОРС, или SARS – severe acute respiratory syndrome). Весной 2003 г. был установлен этиологичекий агент, относящийся к семейству коронавирусов. По данным ВОЗ было зарегистрировано 8098 случаев заболеваемости.
Патогенез. Коронавирусы вызывают поражение верхних дыхательных путей и ЖКТ. Покахана нейротропность вируса, имеются сообщения о выделении коронавирусов из мозга больных рассеянным склерозом.
При тяжелой форме коронавирусной инфекции (атипичной пневмонии) развивается диффузное повреждение альвеол. Нарушается целостность их стенок, повышается проницаемость альвеолокапиллярной мембраны, регулирующей водно-электролитный и газовый обмен. Альвеолы содержат лейкоциты, эритроциты, продукты разрушения клеточных элементов, что клинически соответствует развивающемуся отеку легких.
Клиническая картина. Инкубационный период при ОРВИ составляет 3-4 дня. Заболевание начинается остро и в большинстве случаев протекает с умеренно выраженной интоксикацией и симптомами поражения верхних отделов респираторного тракта. При этом часто основным симптомом является ринит с обильным серозным отделяемым. Иногда заболевание сопровождается слабостью, недомоганием, больные отмечают першение в горле, сухой кашель.
При ТОРС инкубационный период составляет до 10 суток. Начало болезни острое, озноб, температура тела повышается до 39 °С. В первые дни преобладают симптомы интоксикации: головная боль, головокружение, слабость, боль в мышцах. Катаральные симптомы выражены умеренно. На 3-7 сутки болезни развивается респираторная фаза с выраженными признаками поражения нижних дыхательных путей. Нарастает гипоксия и гипоксемия.
При прогрессировании болезни у части больных отмечается синдром острого повреждения легких. Из осложнений отмечается периферическая полинейропатия, острая почечная недостаточность, бактериальная и грибковая суперинфекция. Летальность в случае ТОРС колеблется от 4 до 19 %.
Иммунитет после перенесенного заболевания гуморальный, непродолжительный и не защищает от реинфекции.
Диагностика. Все более широкое применение находит детекция РНК вируса методом ОТ-ПЦР в биологическом материале (кровь, моча, назальный секрет), в т.ч. для ранней диагностики ТОРС.
С помощью непрямого РИФ – с 10-го дня от начала заболевания можно определить нарастание титра IgG в парных сыворотках. В ИФА начиная с 3-й недели определяют IgM и IgG.
Лечение симптоматическое. При ТОРС проводится дезинтоксикационная терапия. Наряду с инфузионной терапией назначают диуретики из-за угрозы отека легких. Показано введение донорского иммуноглобулина, содержащего антитела в высоком титре к коронавирусам.
Профилактика. В настоящее время вакцинопрофилактика при коронавирусной инфекции, в т.ч. ТОРС, не разработана.
 2014-02-05
2014-02-05 3320
3320