Постулат Планка.
Вычисление изменения термодинамических функций.
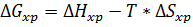
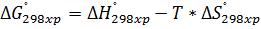

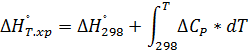
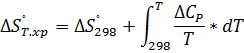
Т, Р-const.
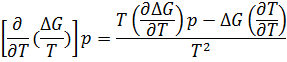
∆G=∆H+T*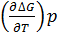
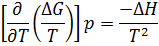
Разделим переменные и проинтегрируем:
∆G= - T*
∆A= - T*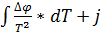
Эйнштейн в теории теплоёмкости твердых тел впервые допустил, что теплоёмкость стремится к нулю.
Нернст выдвинул постулат, из которого следует что кривые в координатах ∆G-T и ∆H-T для любого процесса, для системы, состоящей из кристаллических в-в при 0˚ приближается друг другу.

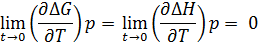
Планк вывел следствие о свойстве энтропии вблизи собственного “0”
∆G=∆H-T∆S
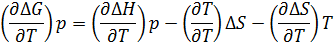
Учитывая тепловую теорему Нернста и переходя к пределам, получаем 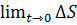 =0
=0
∆S=S2-S1=0 S2=S1=S0=const.
Планк постулировал, что энтропия при достижении абсолютного нуля обращается в “0”
S0=0 – 3-й закон термодинамики
3-й закон термодинамики:
При температуре абсолютного нуля энтропия правильно образованного твердого кристалла любого твердого вещества равна “0”.
 2014-02-05
2014-02-05 451
451








