Химический потенциал чистого вещества.
G=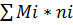
Gi˚=Mi˚*ni˚
Gi˚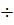 ni˚=gi˚ (мольная энергия Гиббса)
ni˚=gi˚ (мольная энергия Гиббса)
Т.е. мольная функция Гиббса чистого вещества при Т, Р = const. равна его химическому потенциалу.
Mi = f (T, P, n)
P, n = const.
Mi = f (Т)

Химический потенциал с ростом температуры уменьшается, т.к. энтропия по физическому смыслу не может быть отрицательной величиной.
Химический потенциал уменьшается с температурой быстрее, чем химический потенциал конденс. фазы
Зависимость химического потенциала от давления:
Mi= f (T, P, n)
T, n=const
Mi=f (P)
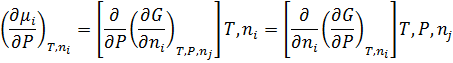
 (мольный объем чистого вещества)
(мольный объем чистого вещества)
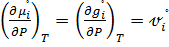
Растет давление – химический потенциал тоже растет

Стандартный химический потенциал
Лекция№6.
Фазовое равновесие
В результате протекания физико-химических процессов перехода веществ из одной фазы системы в другие при определенных условиях устанавливаются равновесия – фазовые.
Фазовые равновесия могут существовать сколько угодно долго при T,P = const и в каждой фазе концентрация не изменяется. При изменении внешних условий наступает новое состояние равновесия. Возможность изменения числа фаз устанавливается правилом Гиббса.
Правило Гиббса.
Компонент – это химически однородное вещ-во, которое может быть выделено из системы и существовать вне ее сколько угодно долго.
Число независимых компонентов равно числу всех индивидуальных веществ, если в системе не протекает химическая реакция. Если протекает хим реакция, то число независимых компонентов Кн=К-Х К – число всех независимых компонентов, Х – число возможных связей между ними.
СаСО3=СаО+СО2
К=3 Х=1 Кн=2
Фаза – это однородная часть системы, отделенная от других частей поверхностью раздела.
Число степеней свободы или вариантность системы – это число независимых параметров, которые можно в определенных пределах изменять без изменения числа и вида фаз
С=Кн-Ф+2
N=2 – число внешних факторов (температура+давление)
Ф – число фаз
Условно-вариантная система
Сусл=Кн-Ф+1 T,P = const
С=0 – безвариантная система
Уравнение Клапейрона-Клаузеуса
Оно выражает зависимость давления от температуры при фазовых переходах для одно- двух-фазной системы
µ0(1)i= µ0(2)i
dµ0(1)i= dµ0(2)i
µi0=gi0=-SiodT+VidP
-Sio(1)dT+ Vi0(1)dP=-Sio(2)dT+Vi0(2)dP
Sio(2)dT-Sio(1)dT= Vi0(2)dP- Vi0(1)dP
dP/dT=ΔSi0ф.п./ ΔVi0ф.п= ΔHi0ф.п./Tф.п.*ΔVi0ф.п - уравнение Клапейрона-Клаузеуса в дифференциальной форме.
Применение правила фаз Гиббса и уравнение Клапейрона-Клаузеуса к однокомпонентной системе.
Диаграмма состояния системы – это диаграмма выражающая зависимость состояния системы и фазовых превращений в ней от внешних условий или состава системы. Для однокомпонентной системы Кн=1. Тогда:
С=3-Ф (правило фаз Гиббса для однокомпонентной системы)
Фmin = 1 Cmax=2
Фmax=2 Cmin=1
В однокомпонентной системе возможно следующее равновесие:
тв=жидк (плавление, кристаллизация)
жид=пар (испарение, конденсация)
тв=пар (возгон, сублимация)
Диаграмма состояния чистого вещества
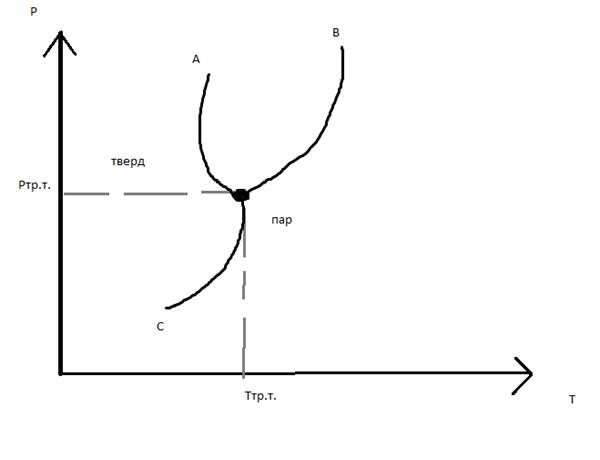
Тр.т. – точка пересечения трех равновесных кривых
0: Ф=3, С=0
1: Ф=2, С=1
2: Ф=1, С=2
Каждая из трех равновесных кривых описывается уравнением Клапейрона-Клаузеуса
(1) ОА: (dP/dT)пл=ΔHi0пл/Тпл(Vi0ж- Vi0тв)
(2) ОВ: (dP/dT)исп= ΔHi0исп /Ткип(Vi0п- Vi0ж)
(3) ОС: (dP/dT)возг=ΔHi0возг/Твозг(Vi0п- Vi0тв)
Все такие фазовые переходы 1го рода (т.е. без изменения состава) можно разделить на 2 группы:
1) когда мольные объемы сосуществующих фаз мало отличаются друг от друга тв=жид
Hi0пл>0
а) (Vi0ж- Vi0тв)>0 выполняется для большинства в-в
(dP/dT)пл>0
б) (Vi0ж- Vi0тв)<0 выполняется для H2O, Bi, Ga
(dP/dT)пл<0
2) когда мольные объемы сосущесвтующих фаз несоизмеримы (т.е. когда имеется паровая фаза)
рассмотрим жид=пар
на Ур-ие (2) наклад 2 ограничения:
1) Viп0>>Viж0
2) паровую фазу считать идеальным газом, отсюда Viп=RT/P
(dlnP/dT)исп= ΔHi0кип/RT2
(dP/dT)>0
Начинается в тр.т. и заканчивается в критической
В критической точкн св-ва пара и жидкости становятся неразличимыми:
Кривая возгонки должна начинаться в точке 0: Р=0, Т=0 (экспериментально недостижимо), а заканчиваться – в тр.т.
ΔHi0возг= ΔHi0пл+ ΔHi0кип
Все эти величины >0
Интегрирование уравнения Клапейрона-Клаузеуса (для испарения)
(dP/dT)исп= ΔHi0/Ткип* ΔVi0исп
lnP=- ΔHi0исп /RTкип+const
const= ΔHi0исп /RTкип
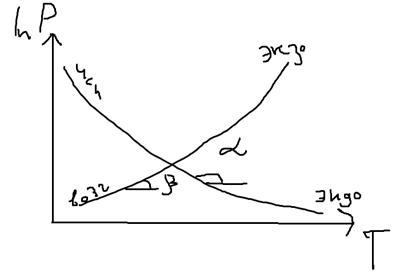
ΔHi0исп=-Rtgα
ΔHi0возг=-Rtgβ
lnP2/P1=ΔHi0исп/R(1/T1-1/T2)
hi0исп,т2= hi0исп,т1+∫t1t2ΔСpdT
hip=- ΔHi0исп/RTкип+∫((∫t1t2ΔСpdT)/RT2кип)+const
Фазовые равновесия в двухкомпонентных системах, содержащих твердую фазу.
В системах, содержащих конденсированные фазы, давление очень мало влияет на состояние равновесия и его не учитывают в формуле правила фаз Гиббса.
Диаграммы плавкости с неограниченной растворимостью компонентов, как в жидком, так и в твердом состоянии.
Такой тип диаграмм обычно образуется близкими по своей природе компонентами.
NaCl-NaBr
Ag-Au
Fe-Ni
Bi-Sb
FeO-MnO и др
Они называются изоморфными вещ-вами
При охлаждении таких систем образуется твердый раствор, т.е. когда атомы одного элемента чередуются с атомами другого в одной кристаллической решетке.
Лекция №7.
Для изоморфных 2-х компонентных систем диаграмма плавкости имеет следующий вид
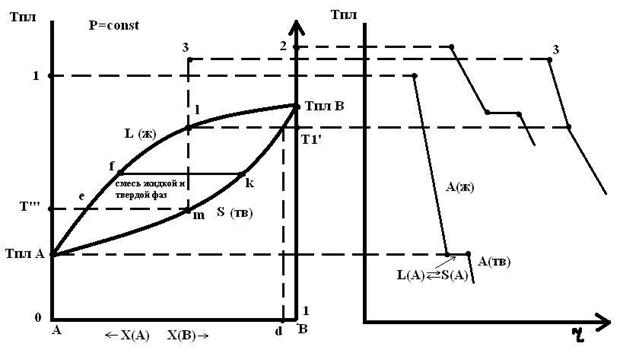
Диаграмма имеет две линии. Верхняя соответствует Т начала кристаллизации (линия ликвидуса), нижняя соответствует Т конца кристаллизации (линия солидуса).
При Тпл.А чистое вещество, если его медленно охлаждать, будет кристаллизоваться при постоянной температуре.
На кривой охлаждения появляется площадка. Температура будет оставаться постоянной, пока не исчезнет последняя капля жидкости, а затем будет охлаждаться твердое в-во А.
Сусл(а)= к-ф+1= 1-2+1=0
При t=Т1’ появляются первые кристаллы твердового раствора состава d.
Определим этот состав. Надо из точки l провести ноду (прямую, параллельную оси абсцисс, соединяющую составы равновесных фаз). При кристаллизации выделяется теплота кристаллизации и кривая охлаждения пойдет более полого.
Сусл(l)= 2-2+1=1
Состав жидкой фазы меняется по линии ликвидуса, а твердой фазы – по линии солидуса.
Эти составы будут меняться до тех пор, пока не исчезнет последняя капля жидкости. Ткрист состава 3 = Т’’’. Т.е. когда состав твердого раствора m совпадает с составом взятого для охлаждения жидкого состава l.
Соотношение между массами твердой и жидкой фаз для системы в точке 3 при ее охлаждении до температуры определяется правилом рычага.
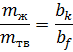
Главная особенность неизоморфных смесей то, что они в твердом состоянии неоднородны, состоят из двух твердых фаз. В жидком состоянии они полностью взаиморастворимы.
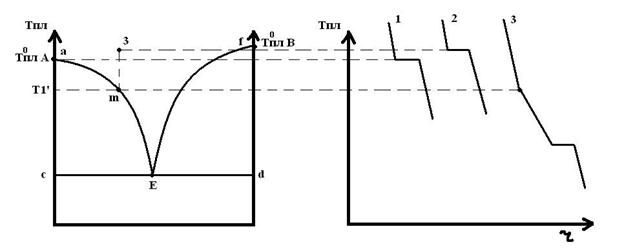
Линия ликвидуса состоит из двух ветвей aE и Ef, которые сходятся в точке Е. Через точку Е проходит линия солидуса. При медленном охлаждении до точки m мы будем находиться в жидкой фазе. В точке m при T’ начинают выпадать кристаллы чистого вещества А, т.к. смесь состава 3 насыщена больше компонентом А. При выпадении кристаллов А расплав обогащается компонентом В. При Те жидкий состав становится насыщенным веществом В и начинают выпадать кристаллы обоих компонентов, эта t называется эвтептической, а точка Е – эвтептика. При этой t в равновесии находятся 3 фазы, жидкий расплав, кристаллы А и В.
Сусл(Е) = 2-3+1=0
Сусл(3) = 2-1+1=2
Сусл(m) = 2-2+1=1
Диаграмма состояния равновесия «жидкость – пар». Законы Коновалова.
Состав двухкомпонентных смесей определяется температурой, давлением и содержанием обоих веществ в каждой фазе. На практике такие системы определяются при Т или Р = const.
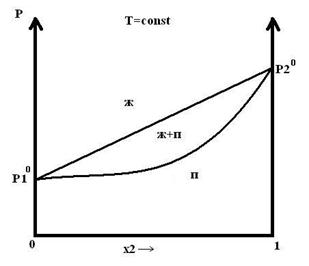 ж: P = f(x2,ж) прямолин.
ж: P = f(x2,ж) прямолин.
п: P = f(x2,п) криволин.
1 – растворитель
2 – раств. Вещество
Для реальных растворов существую диаграммы трех типов:
1 образуют реальные растворы с незначительным отклонением от идеальности.
2 и 3 образуют растворы со значительным отклонением от идеальности.
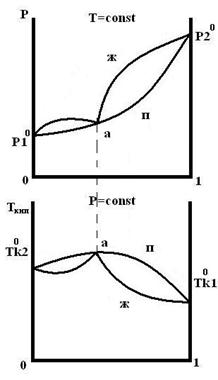
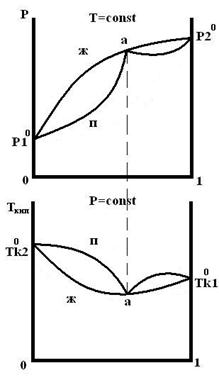
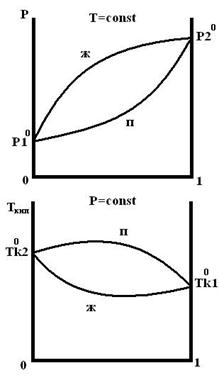 1 тип 2 тип 3 тип
1 тип 2 тип 3 тип
Сусл(п,ж) = 2-1+1=2
Сусл(ж+п) = 2-2+1=1
М – состав раствора.
Лекция №8.
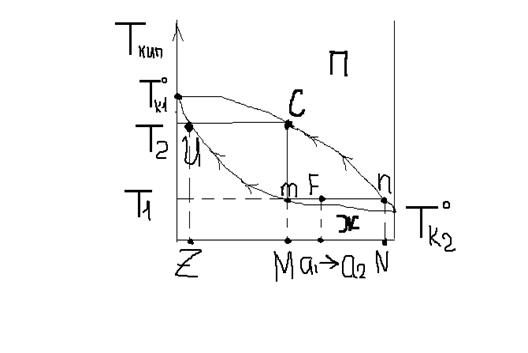
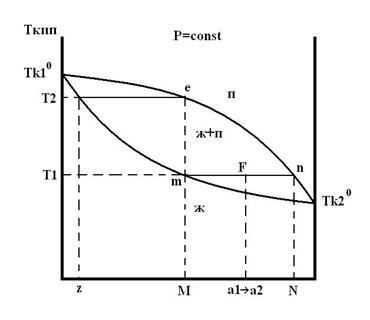
Диаграмма имеет две линии: верхняя- линия пара, нижняя- жидкости. Плоскость диаграммы разделена на 3 области.
С усл.(пар.,жид.)=2-1+1=2
С усл.(жид+пар.)=2-2+1=1
Точки, лежащие на линии жидкости, показывают составы жидких смесей и температуры, при которых начинает кипеть раствор заданного состава при данном давлении. m показывает, что состав M начинает кипеть в точке Т1. Если из точки m провести ноду, то точка пересечения с линией пара n показывает состав первого пузырька пара. Как только раствор состава М закипит, то состав жидкости меняется по линии жидкости, а состав пара- по линии пара. Кипение закончится при температуре Т2. Жидкость вся перейдет в пар. Это произойдет, когда состав пара совпадет с составом взятого жидкого раствора (С с М). Последняя капля жидкости будет иметь состав Z. При температуре Т1 все смеси состава F, а1,а2…, т.е. составов между M и N, будут содержать 2 фазы: жидкую и паровую.
Найдем массу жидкой и паровой фаз в F с помощью правила рычага.: массы равновесных сосуществующих фаз обратно пропорциональны отрезкам, на которые делит ноду точка, отвечающая заданному составу бинарной смеси.
m ж./m п.=F п./F
Как видно из диаграммы, при равновесии состав жидкой фазы не совпадает с составом паровой фазы.
Связь между изменением состава жидкой и паровой фаз, давлением и температурой устанавливается первым законом Коновалова:
1) В бинарной системе пар, по сравнению с жидким раствором, из которого он получен, при равновесии богаче тем компонентом, добавление которого к раствору понижает температуру кипения раствора или повышает общее давление при заданной температуре.
2) Пар всегда богаче более легко летучим компонентом.
Второй закон Коновалова касается бинарных растворов, образующих азиотропную смесь.
Азиотропная смесь -это раствор, при испарении которого получается пар такого же состава, что исходная жидкая смесь.
В азиотропных смесях, изображенных на диаграмме состояния равновесия жидкость-пар, в экстремальных точках составы жидкости и пара совпадают.
В реальных растворах со значительным положительным отклонением от идеальности (от закона Рауля) азиотропная смесь имеет самую низкую температуру кипения (2-ой тип).
И наоборот, со значительным отрицательным отклонением от закона Рауля, самую высокую температуру кипения. Состав азиотропной смеси при его кипении не изменяется, и температура кипения при заданном внешнем давлении остается постоянной, как у чистых веществ. Но, при изменении внешнего давления меняется не только температура кипения, но и его состав. Это указывает на то, что азиотроп не является химическим соединением. Например, при повышении давления от 760 до 1000 мм р ст. состав азиотропа вода-этанол изменяется с 89% спирта до 99,6% спирта. На этом основан метод разрушения нежелательных азиотропов при очистке веществ перегонкой.
Изменение состава паровой фазы при постоянстве состава жидкого раствора с изменением температуры или давления описывается правилами Вревского:
1) при повышении температуры раствора постоянного состава, его пар обогащается тем компонентом, у которого больше парциальная мольная теплота испарения.
2) Если бинарная система характеризуется минимальной температурой кипения (мах Р), то при повышении температуры в азиотропной смеси возрастает концентрация того компонента, у которого выше парциальная мольная теплота испарения. Если система характеризуется максимальной температурой кипения (min Р), то с возрастанием температуры в азиотропной смеси возрастает концентрация того компонента, у которого парциальная мольная теплота испарения меньше.
3) Если бинарная система характеризуется минимальной температурой кипения, то при изменении температуры, состав пара и состав азиотропной жидкой смеси изменяется в одном и том же направлении. Для системы с максимальной температурой кипения, с изменением температуры состав пара и азиотропной жидкой смеси изменяются в противоположном направлении.
 2014-02-05
2014-02-05 7443
7443
