Формулировка Оствальда.
Постулат Томпсона.
Невозможен циклический процесс единственным результатом, которого было бы превращение всей теплоты полученной от теплоисточника в работу без одновременного переноса части теплоты от теплоисточника к холодильнику.
Вечный двигатель второго рода невозможен, т.е. невозможно создать машину, которая полностью превращала бы теплоту подведённую из окружающей среды в работу.
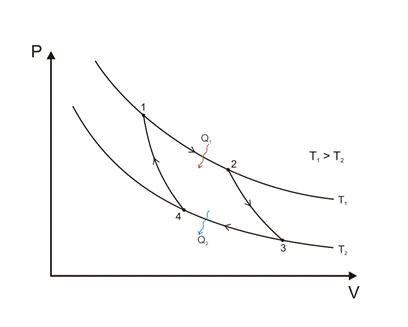
Для получения работы в тепловой машине необходимо наличие 2ух тепловых систем с разными температурами.
Q1 – передано холодильник -> тело
Q2 – передано тело -> холодильник
1 – 2 Изотермическое расширение
2 – 3 Адиабатическое расширение
3 – 4 Изотермическое сжатие
4 – 3 Адиабатическое сжатие
W=Q1 – Q2
КПД идеальной машины Карно не зависит от природы рабочего тела, а зависит только от температуры теплоисточника и холодильника.
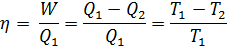
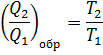
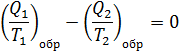
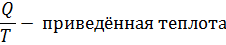
Для цикла алгебраическая сумма приведённых теплот с учётом знаков равна 0.
Любой круговой процесс можно разбить на бесконечное множество циклов Карно.
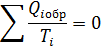
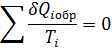
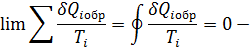
Первое обобщение Клазиоса для равновесных циклов
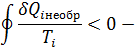
Второе обобщение Клазиоса для равновесных циклов
Если круговой интеграл равен нулю то подынтегральная величина есть полный дифференциал некоторой функции состояния.
Клаузиус назвал её энтропией.
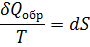
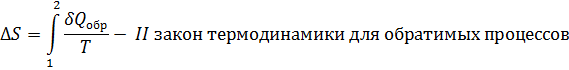
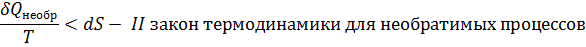
Энтропия – это функция состояния её изменения не зависят от пути процессов, но изменение энтропии 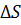 можно вычислить лишь на обратимом пути т.к. соотношение между
можно вычислить лишь на обратимом пути т.к. соотношение между 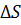 и
и 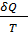 определено равенством.
определено равенством.
Энтропия как критерий направленности процесса.
Для изолированной системы
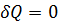 , для обратимого процесса
, для обратимого процесса
 , для необратимого
, для необратимого 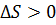
 |
 - запись II з-на термодинамики для изолированной системы
- запись II з-на термодинамики для изолированной системы
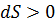
При протекании обратимого процесса энтропия сохраняет своё постоянное значение, а необратимого возрастает.



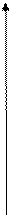 Таким образом, в изолированной системе любой самопроизвольный процесс сопровождается возрастанием энтропии, пока не наступит равновесие, при котором энтропия максимальна.
Таким образом, в изолированной системе любой самопроизвольный процесс сопровождается возрастанием энтропии, пока не наступит равновесие, при котором энтропия максимальна.
S
Smax 
Ход процесса
Критерий направленности процесса 
Система в результате протекания в ней самопроизвольного процесса переходит из состояния менее вероятного (более упорядоченного) в состояние более вероятное (менее упорядоченное) в результате чего энтропия возрастает.
Таким образом, энтропия – мера неупорядоченности системы.
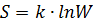
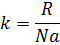
W – Термодинамическая вероятность перехода системы из менее вероятного состояния в более вероятное.
1) SH2O, лёд< SH2O,жидк. < SH2O,пар
2) При нагревании энтропия увеличивается, при охлаждении уменьшается.
3) Энтропия возрастает с усложнением структуры молекул.
Характеристические термодинамические функции.
Рассмотрим обратимый процесс, в котором будет только объёмный вид работы.
1)S, V = const –изохорно изоэнтропический.
dU=δQ-pdV
δQ=TdS
dU=TdS-pdV (1)
U=f(S,V) –изохорный изоэнтропический потенциал.
dU=(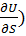 v dS +(
v dS +(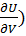 sdV (2)
sdV (2)
(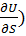 v =T (3) (
v =T (3) (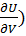 s=-p (4)
s=-p (4)
T – является мерой увеличения внутренней энергии системы при изохорном увеличении энтропии.
V – является мерой убыли внутренней энергии системы при изоэнтропийном увеличении объёма.
Такие функции состояния, посредством которых через их частные производные по независимым переменным можно в явном виде выразить термодинамические свойства системы, называются характеристическими.
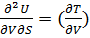 s
s
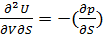 v
v
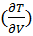 s=
s=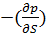 v – уравнение Максвела.
v – уравнение Максвела.
2) S, P = const
H=U+pV
dH=dU+pdV+Vdp=TdS-pdV+pdV+VdT
dH=TdS+VdT (5) объединённое уравнение термодинамики для S, P = const
H=f(S,P)
dH=(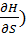 p dS +(
p dS +(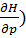 sdp (6)
sdp (6)
(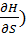 p =T (7) (
p =T (7) (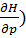 s=V (8)
s=V (8)
T – является мерой возрастания энтальпии системы при изобарном увеличении энтропии.
V – является мерой возрастания энтальпии при изоэнтропийном увеличении давления.
(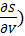 p= (
p= (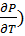 s
s
3) T, V =const
Из dU вычтем полный дифференциал d(T∙S)
dU – d(T∙S) = TdS-pdV – d(T∙S)
dU-d(T∙S) = TdS – pdV – SdT – TdS
d(U – TS) = -SdT – pdV
A = U – TS
A = f(T,V)
dA = -SdT – pdV (9)
dA=(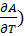 v dT +(
v dT +(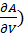 TdV (10)
TdV (10)
Из сравнения (9) и (10)
(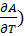 V = - S(11) (
V = - S(11) (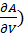 s= - p (12)
s= - p (12)
(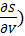 T= (
T= (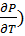 V
V
4) T,P = const
dH – d(T∙S) = TdS-Vdp – d(T∙S) = TdS + Vdp – TdS - SdT
d(H – TS) = -SdT – Vdp
G = H – TS
G = f(T,p)
dG = -SdT + Vdp (13)
dG=(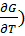 p dT +(
p dT +(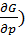 Tdp (14)
Tdp (14)
(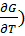 p = - S(15) (
p = - S(15) (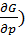 T= V (14)
T= V (14)
(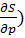 T= - (
T= - (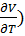 p
p
Связь между A и G
G = H – TS = U + pV – TS = U – TS+pV = ApV
G = A + pV

∆G = ∆H - T∆S - уравнения Гиббса – Гельмгольца
∆A = ∆U - T∆S
Физический смысл изменения характерестических функций.
Критерий самопроизвольного протекания процесса.
1)S,V = const
dU≤ TdS – δW ≤ TdS – pdV – δW`
dS, dV = 0
dUs,V ≤ -δW`
-dUs,V≥δW` - критерий самопроизвольного протекания процесса.
2) p,S = const
dH≤TdS + Vdp – δW`
dS, dp = 0
dHs,p ≤ -δW`
-dHs,p ≥ δW` - критерий самопроизвольного протекания процесса.
3) T,V = const
dA≤ -SdT – pdV - δW`
dT, dV = 0
dAT,V ≤ -δW`
-dAT,V≥δW`
4) T,P = const
dG≤ -SdT – Vdp - δW`
dT, dp = 0
dG ≤ -δW`
-dGT,p≥δW`
Условием самопроизвольного протекания процесса является возможность системы произвести работу, т.е. W`>0. Таким образом, при самопроизвольном протекании любого химического процесса в закрытой системе термодинамические потенциалы(U,H,A,G) должны уменьшаться при постоянстве соответствующих параметров.
Достижение равновесия свидетельствует о минимальной величине соответственного потенциала.
Критерий направленности химических реакций.
1) S,V = const
–dUsv ≥ δW`
δW` = 0
-dUs,v ≥ 0
dUs,v ≤ 0
∆Usv≤0
2) S,p = const
–dHsp ≥ δW`
-dHs,p≥ 0
dHs,p ≤ 0
3) T,V = const
dAT,V ≤ 0
4) T,p = const
dGT,P ≤ 0
Лекция №5.
 2014-02-05
2014-02-05 1163
1163








