1)Химический потенциал компонентов системы является интенсивным свойством, не зависит от общей массы системы, зависит только от свойства.
2)Химический потенциал является критерием направления и равновесия в самопроизвольных процессах.
Рассмотрим гетерогенную систему, состоящую из i компонентов расположенных между 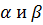 фазами, температура в каждой фазе одинакова.
фазами, температура в каждой фазе одинакова.
Процесс в системе состоит из перехода х моль i-го компонента из фазы 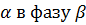 .
.
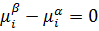
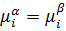
Самопроизвольное протекание процесса в сторону уменьшения химического потенциала и при растворе наступает равновесие.
3)Химический потенциал компонентов связан между собой уравнениями Гиббса - Дигамма
G=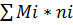 (1)
(1)
Показывает, что ∆G раствора определяется количеством моль и химическими потенциалами отдельных компонентов
dG =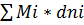 +
+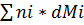
dG =Mi+dni
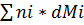 =0 (2)
=0 (2)
n1dMi-n2dM2=0
 2014-02-05
2014-02-05 3133
3133
