В)Сердечная мышечная
Многослойный эпителий (см. рисунок)
Задачи
Химическими реакциями называются явления, при которых одни вещества, обладающие определенным составом и свойствами, превращаются в другие вещества - с другим составом и другими свойствами. При этом в составе атомных ядер изменений не происходит.
Стратегия финансирования.
В этом разделе необходимо показать следующие данные:
-какой объем инвестиций необходим для реализации проекта;
-откуда намечается получить эти средства;
-когда можно ожидать полного возврата вложенных средств и получение инвестором дохода.
Рассмотрим типичную химическую реакцию: сгорание природного газа (метана) в кислороде воздуха. Те из вас, у кого дома есть газовая плита, могут ежедневно наблюдать эту реакцию у себя на кухне. Запишем реакцию так, как показано на рис. 5-1.
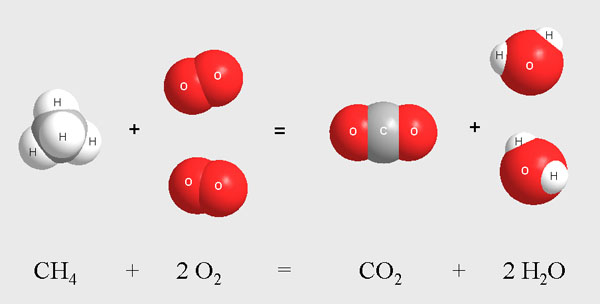
Рис. 5-1. Метан СН4 и кислород О2 реагируют между собой с образованием диоксида углерода СО2 и воды Н2О. При этом в молекуле метана разрываются связи между С и Н и на их месте возникают связи углерода с кислородом. Атомы водорода, ранее принадлежавшие метану, образуют связи с кислородом. На рисунке хорошо видно, что для успешного осуществления реакции на одну молекулу метана надо взять две молекулы кислорода.
Записывать химическую реакцию с помощью рисунков молекул не слишком удобно. Поэтому для записи химических реакций используют сокращенные формулы веществ - как это показано в нижней части рис. 5-1. Такая запись называется уравнением химической реакции.
Количество атомов разных элементов в левой и правой частях уравнения одинаково. В левой части один атом углерода в составе молекулы метана (СН4), и в правой - тот же атом углерода мы находим в составе молекулы СО2. Все четыре водородных атома из левой части уравнения мы обязательно найдем и в правой - в составе молекул воды.
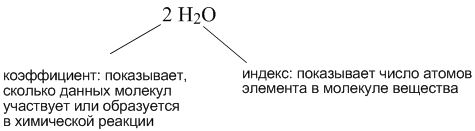
В уравнении химической реакции для выравнивания количества одинаковых атомов в разных частях уравнения используются коэффициенты, которые записываются перед формулами веществ. Коэффициенты не надо путать с индексами в химических формулах.
Рассмотрим другую реакцию - превращение оксида кальция СаО (негашеной извести) в гидроксид кальция Са(ОН)2 (гашеную известь) под действием воды.
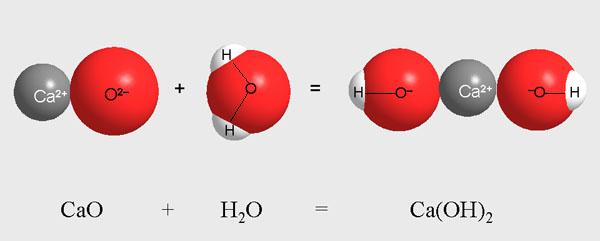
Рис. 5-2. Оксид кальция СаО присоединяет молекулу воды Н2О с образованием
гидроксида кальция Са(ОН)2.
В отличие от математических уравнений, в уравнениях химических реакций нельзя переставлять левую и правую части. Вещества в левой части уравнения химической реакции называются реагентами, а в правой - продуктами реакции. Если сделать перестановку левой и правой части в уравнении из рис. 5-2, то мы получим уравнение совсем другой химической реакции:
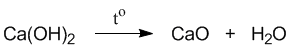
Если реакция между СаО и Н2О (рис. 5-2) начинается самопроизвольно и идет с выделением большого количества теплоты, то для проведения последней реакции, где реагентом служит Са(ОН)2, требуется сильное нагревание.
Обратите внимание: вместо знака равенства в уравнении химической реакции можно использовать стрелку. Стрелка удобна тем, что показывает направление течения реакции.
Добавим также, что реагентами и продуктами могут быть не обязательно молекулы, но и атомы - если в реакции участвует какой-нибудь элемент или элементы в чистом виде. Например:
H2 + CuO = Cu + H2O
Существует несколько способов классификации химических реакций, из которых мы рассмотрим два.
По первому из них все химические реакции различают по признаку изменения числа исходных и конечных веществ. Здесь можно найти 4 типа химических реакций:
- реакции СОЕДИНЕНИЯ,
- реакции РАЗЛОЖЕНИЯ,
- реакции ОБМЕНА,
- реакции ЗАМЕЩЕНИЯ.
Приведем конкретные примеры таких реакций. Для этого вернемся к уравнениям получения гашеной извести и уравнению получения негашеной извести:
СаО + Н2О = Са(ОН)2
Са(ОН)2 = СаО + Н2О
Эти реакции относятся к разным типам химических реакций. Первая реакция является типичной реакцией соединения, поскольку при ее протекании два вещества СаО и Н2О соединяются в одно: Са(ОН)2.
Вторая реакция Са(ОН)2 = СаО + Н2О является типичной реакцией разложения: здесь одно вещество Ca(OH)2 разлагается с образованием двух других.
В реакциях обмена количество реагентов и продуктов обычно одинаково. В таких реакциях исходные вещества обмениваются между собой атомами и даже целыми составными частями своих молекул. Например, при сливании раствора CaBr2 с раствором HF выпадает осадок. В растворе ионы кальция и водорода обмениваются между собой ионами брома и фтора. Реакция происходит только в одном направлении потому, что ионы кальция и фтора связываются в нерастворимое соединение CaF2 и после этого "обратный обмен" ионами уже невозможен:
CaBr2 + 2HF = CaF2¯ + 2HBr
При сливании растворов CaCl2 и Na2CO3 тоже выпадает осадок, потому что ионы кальция и натрия обмениваются между собой частицами CO32– и Cl– с образованием нерастворимого соединения - карбоната кальция CaCO3.
CaCl2 + Na2CO3 = CaCO3¯ + 2NaCl
Стрелка рядом с продуктом реакции показывает, что это соединение нерастворимо и выпадает в осадок. Таким образом, стрелку можно использовать и для обозначения удаления какого-нибудь продукта из химической реакции в виде осадка (¯) или газа (↑). Например:
Zn + 2HCl = H2↑ + ZnCl2
Последняя реакция относится к еще одному типу химических реакций - реакциям замещения. Цинк заместил водород в его соединении с хлором (HCl). Водород при этом выделяется в виде газа.
Реакции замещения внешне могут быть похожи на реакции обмена. Отличие заключается в том, что в реакциях замещения обязательно участвуют атомы какого-нибудь простого вещества, которые замещают атомы одного из элементов в сложном веществе. Например:
2NaBr + Cl2 = 2NaCl + Br2 - реакция замещения;
в левой части уравнения есть простое вещество – молекула хлора Cl2, и в правой части есть простое вещество – молекула брома Br2.
В реакциях обмена и реагенты и продукты являются сложными веществами. Например:
CaCl2 + Na2CO3 = CaCO3¯ + 2NaCl - реакция обмена;
в этом уравнении реагенты и продукты - сложные вещества.
Деление всех химических реакций на реакции соединения, разложения, замещения и обмена - не единственное. Есть другой способ классификации: по признаку изменения (или отсутствия изменения) степеней окисления у реагентов и продуктов. По этому признаку все реакции делятся на окислительно-восстановительные реакции и все прочие (не окислительно-восстановительные).
Реакция между Zn и HCl является не только реакцией замещения, но и окислительно-восстановительной реакцией, потому что в ней изменяются степени окисления реагирующих веществ:
Zn0 + 2H+1Cl = H20 + Zn+2Cl2 - реакция замещения и одновременно окислительно-восстановительная реакция.
Окислительно-восстановительными являются также реакции метана с кислородом (рис. 5-1), реакция оксида меди с водородом, реакция бромида натрия с хлором.
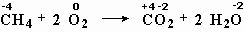
меняют степень окисления углерод и кислород,
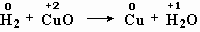
меняют степень окисления водород и медь,
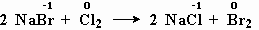
меняют степень окисления бром и хлор.
А вот все остальные реакции, рассмотренные в этом параграфе, окислительно-восстановительными не являются, потому что в них не изменяются степени окисления атомов ни в реагентах, ни в продуктах.
5.1. На месте знаков “?” правильно заполните пропуски в уравнениях химических реакций:
Ca + 2HCl = Ca”?” + H2 ↑
2Mg + “?” = 2MgO
2H2”?” + 3O2 = 2H2O + 2SO2
Fe2O3 + 3H2 = 2Fe + 3”?”O
CaCl2 + 2NaOH = Ca(OH)2 + 2Na”?”
5.2. Приведены 8 разных химических реакций. а) Найдите среди них реакции соединения, разложения, замещения и обмена. Запишите их уравнения в 4 столбика (по две реакции каждого типа в столбике); б) Уравняйте реакции; в) Подчеркните те реакции, которые являются окислительно-восстановительными. Укажите в них степени окисления атомов в реагентах и продуктах:
H2 + O2 = H2O (реакция идет со взрывом)
Zn + CuCl2 = Cu + ZnCl2 (реакция происходит в растворе)
NH3 = N2 + H2 (реакция идет при нагревании в газовой фазе)
Cu + S = CuS (реакция идет при нагревании порошков Cu и S)
AgF + NaCl = AgCl¯ + NaF (реакция происходит в растворе)
CaCO3 = CaO + CO2 ↑ (реакция происходит при нагревании)
CuBr2 + NaOH = Cu(OH)2¯ + NaBr (реакция происходит в растворе)
Fe + H2O = H2↑ + Fe2O3 (реакция происходит при нагревании)
Многослойный плоский неороговевающий эпителий. Выстилает роговицу, передний отдел пищеварительного канала и участок анального отдела пищеварительного канала. Клетки располагаются в несколько слоёв.
Многослойный плоский ороговевающий эпителий — эпидермис, он выстилает кожные покровы. В толстой коже (ладонные поверхности), которая постоянно испытывает нагрузку, эпидермис содержит 5 слоёв:
3)Переходный эпителий (уроэпителий) выстилает мочевыводящие пути. 3-4 слоя клеток. Толщина этого эпителия меняется в зависимости от степени растяжения стенки мочевыводящих органов. Эпителий способен выделять секрет, защищающий его клетки от воздействия мочи
4)Железистый эпителий Разновидность эпителиальной ткани, которая состоит из железистых клеток, которые в процессе эволюции приобрели ведущее свойство вырабатывать и выделять секреты. Такие клетки называются секреторными (железистыми) — гланулоцитами. Они имеют точно такую же общую характеристику как покровный эпителий. Расположен в железах кожи, кишечнике, слюнных железах, железах внутренней секреции и др. Cреди эпителиальных клеток находятся секреторные клетки, их 2 вида
экзокринные — выделяют свой секрет во внешнюю среду или просвет органа.
эндокринные — выделяют свой секрет непосредственно в кровоток.
II) Соединительные ткани — это большая и многообразная группа, которая объединяет собственно соединительные ткани, кровь, скелетные ткани. При кажущемся различии все перечисленные ткани объединяются общностью происхождения, так как все они возникают из мезенхимы. Общие признаки строения соединительных тканей: наличие сильно развитого межклеточного вещества и разнообразие форм клеток.
1)Собственно соединительные ткани широко распространены в организме человека. Межклеточное вещество этих тканей состоит из основного вещества и волокон (рис. 8). Основное вещество заполняет все промежутки между клетками и волокнами.
Основное вещество образуется клетками соединительной ткани — фибробластами.
В основном веществе располагаются соединительнотканные волокна. Различают три основные разновидности волокон: коллагеновые, обеспечивающие механическую прочность тканей, эластические, придающие тканям гибкость, нерастяжимость, и ретикулярные.
В зависимости от степени упорядоченности волокон в межклеточном веществе различают три вида соединительных тканей: 1) рыхлую волокнистую соединительную ткань; 2) плотную волокнистую соединительную ткань; 3) ретикулярную соединительную ткань.
Рыхлая волокнистая соединительная ткань содержит клетки разнообразной формы (фибробласты, фиброциты и др.). Эта ткань наиболее распространена. Она сопровождает все кровеносные и лимфатические сосуды, нервы, формирует соединительнотканные прослойки и оболочки органов, входит в состав кожи и слизистых оболочек.
Плотная волокнистая соединительная ткань характеризуется преобладанием волокон над клетками и основным веществом; она формирует оболочки органов, надкостниц, сухожилия и связки.
Ретикулярная ткань образует основу (строму) кроветворных и иммунных органов. Вней размножаются и развиваются все клетки крови и иммунной системы.
2)Кровь и лимфа вместе с рыхлой соединительной тканью образуют внутреннюю среду организма. Кровь и лимфа состоят из двух основных компонентов: плазмы (жидкого межклеточного вещества) и находящихся в ней клеток. Плазма крови представляет собой жидкость, содержащую 90-93% воды и 7-10% сухих веществ. К форменным элементам крови (рис. 9) относят эритроциты, лейкоциты и кровяные пластинки (тромбоциты). Лимфа почти прозрачная желтоватая жидкость, находящаяся в лимфатических капиллярах и сосудах, она состоит из жидкой части - лимфоплазмы и
форменных элементов, представленных главным образом лимфоцитами.
3)К скелетным тканям относят хрящевые и костные ткани. Они выполняют опорную, защитную, механическую функции, а также принимают участие в минеральном обмене.
А) Хрящевые ткани состоят из зрелых хрящевых клеток — хондроцитов и молодых клеток — хондробластов, а также межклеточного вещества, которое отличается упругостью. В соответствии со строением и составом межклеточного вещества различают три разновидности хрящевой ткани: гиалиновую, эластическую, волокнистую.
Гиалиновая, или стекловидная, хрящевая ткань (от греч. hуаlоs — стекло) образует хрящевые части ребер, покрывает суставные поверхности костей, входит в состав стенок органов дыхания — гортани, трахеи, бронхов.
Эластический хрящ служит скелетом гибких органов — ушных раковин, некоторых хрящей гортани. В нем также присутствуют эластические волокна.
Волокнистый хрящ образует межпозвоночные диски, находится в местах прикрепления сухожилий и связок к костям. Межклеточное вещество этого хряща содержит пучки коллагеновых волокон, придающие этому хрящу повышенную прочность.
В)Для образования достаточно прочного внутреннего скелета в процессе эволюции у позвоночных животных появляется еще одна разновидность скелетных тканей — костная ткань. Она также состоит из костных клеток и достаточно хорошо развитого, пропитанного солями межклеточного вещества.
В костной ткани различают три вида клеток: остеобласты, остеоциты и остеокласты.
Остеобласты — молодые костные клетки.
Остеоциты — это зрелые, неспособные к делению костные клетки.
Остеокласты — это клетки-разрушители. Они участвуют в перестройке костной ткани. Остеокласты способны разрушать кость и обызвествленный хрящ.
Межклеточное вещество костной ткани состоит из аморфного вещества и коллагеновых волокон, пропитанных солями кальция, фосфора и других химических элементов. В соответствии со строением межклеточного вещества различают грубоволокнистую и пластинчатую костную ткань.
Грубоволокнистая костная ткань. Встречается эта ткань в местах прикрепления сухожилий к костям.
Пластинчатая костная ткань Из пластинчатой костной ткани построено компактное и губчатое вещество костей скелета.
III)Мышечные ткани имеют различное происхождение и строение. Они объединены по функциональному признаку — сократимости. Сократимость — одно из основных свойств живых клеток — достигает наибольшего развития у мышечных тканей. Различают гладкую, поперечно-полосатую и сердечную мышечные ткани, имеющие различное строение.
А)Гладкая (неисчерченная) мышечная ткань располагается в стенках полых внутренних органов, кровеносных и лимфатических сосудов, протоков желез, а также в некоторых других органах. Эта ткань состоит из гладкомышечных клеток (миоцитов) веретенообразной формы. Длина гладкомышечной клетки — около 100 мкм. Гладкая мышечная ткань сокращается непроизвольно, подчиняясь импульсам вегетативной (автономной) нервной системы, неподконтрольной нашему сознанию.
Б)Поперечно-полосатая (исчерченная) мышечная ткань образует скелетные мышцы, поэтому ее называют также скелетной мышечной тканью. Эта ткань построена из волокон, имеющих длину от долей миллиметра до нескольких сантиметров. Каждое мышечное волокно имеет до 100 и более ядер. Волокна имеют чередующуюся светлую и темную окраску, в связи с чем ткань и получила свое название. Сокращается поперечно-полосатая мышечная ткань произвольно, подчиняясь сознательным движениям, усилиям воли.
ткань состоит из клеток, имеющих поперечно-полосатую исчерченность. Сокращается эта ткань непроизвольно, подчиняясь автоматизму сердечных ритмов.
IV)Нервная ткань — основная ткань органов нервной системы (головного и спинного мозга, нервов).
Состоит она из нервных клеток различной величины (размеры тела клетки до 150 мкм) и формы и клеток нейроглии, выполняющих вспомогательные функции.
Криминалистика – наука о технических средствах, тактических приемах и методах, применяемых для выполнения предусмотренных уголовно-процессуальным законом действий по обнаружению, собиранию, фиксации, исследованию, оценке и использованию доказательств в целях раскрытия и предупреждения преступлений.
Криминалистика – это наука о раскрытии, расследовании и предупреждении преступлений.
Предмет криминалистики – закономерности, характеризующие процесс раскрытия преступлений.
Эти закономерности различны по своему уровню. Одни носят более общий характер и выражены, например, в общих положениях(принципах) методики расследования. Другие имеют более узкое значение и представляют собой многочисленные особенности применения отдельных технико-криминалистических средств и тактических приемов при производстве следственных действий.
Объекты изучения криминалистики:
1) преступная деятельность и все, что связано с подготовкой совершения, реализацией и сокрытием преступления;
2) криминалистическая деятельность:
а) деятельность по расследованию преступлений (работа следователей, прокуроров, дознавателей);
б) деятельность экспертов при производстве экспертных исследований;
в) оперативно-разыскная деятельность;
г) научно-педагогическая деятельность. Криминалистика изучает и обобщает:
1) криминалистическую практику (совершенные преступления). Криминалистический анализ преступлений предполагает выявление тех тенденций (закономерностей), всего общего, типичного, что свойственно подготовке, совершению различных видов (групп) преступлений, и создание соответствующих видов криминалистических характеристик;
2) следственную практику. При изучении и научном обобщении практики раскрытия преступлений выявляется все общее, типичное, что характеризует работу следователя по организации и планированию расследования, выдвижению следственных версий применительно к типичным криминальным и следственным ситуациям;
3) практику использования криминалистической техники в различных формах;
4) современные достижения естественных, технических и общественных наук, являющиеся одним из источников развития криминалистической техники и следственной тактики;
5) практику применения естественных, технических и общественных наук.
Задачи криминалистики делятся на две группы:
1) основные – это разработка новых приемов, методов, внедрение в практику следствия и суда наиболее передовых и эффективных методов работы с доказательствами;
2) вспомогательные – обобщение передового положительного и отрицательного опыта работы следователей и формирование выводов о причинах ошибок при производстве различных следственных действий.
Правовые основы криминалистики – положения, закрепленные в УПК РФ, в Законе об оперативно-разыскной деятельности и в ГПК РФ, подзаконные акты, приказы Генерального прокурора, приказы МВД России, инструкции, предписания и рекомендации научно-практические.
 2014-02-02
2014-02-02 617
617








