Осмос
При разделении двух растворов различной концентрации или раствора и чистого растворителя полупроницаемой перегородкой (мембраной) возникает поток растворителя от раствора с меньшей концентрацией к раствору с большей концентрацией, приводящий к выравниванию концентраций (рис. 49). Этот процесс называется осмосом.
 Осмос характерен не только для истинных растворов, но и для коллоидных растворов. Молекулы растворителя переходят через полупроницаемую мембрану в сосуд с коллоидным раствором. В результате в нем создается избыточное давление π, называемое осмотическим.
Осмос характерен не только для истинных растворов, но и для коллоидных растворов. Молекулы растворителя переходят через полупроницаемую мембрану в сосуд с коллоидным раствором. В результате в нем создается избыточное давление π, называемое осмотическим.
Осмотическое давление – это избыточное давление над раствором, которое необходимо для исключения переноса растворителя через мембрану.
Для расчета осмотического давления коллоидных растворов применяется уравнение:
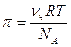 ,
,
где νч – численная концентрация частиц.
Осмотическое давление коллоидных растворов намного меньше осмотического давления истинных растворов, так как при одной и той же весовой концентрации численная концентрация коллоидного раствора всегда меньше истинного раствора.
Раздел VII.
 2014-02-02
2014-02-02 923
923








