К пятой аналитической группе катионов относятся ионы Fe2+, Fe3+, Mn2+, Mg2+, Ионы Мn2+ и Mg2+ - бесцветные, ионы Fe2+ - бледно-зеленые, а ионы Fe3+— желтые. Нитраты, сульфаты и хлориды катионов этой группы хорошо растворимы в воде. Гидроксиды катионов этой группы слабые труднорастворимые электролиты. Они не растворяются в избытке щелочи и в растворе аммиака, чем отличаются от гидроксидов четвертой и шестой групп. Групповым реагентом является NaOH.
Все соли катионов пятой аналитической группы подвергаются гидролизу, особенно соли железа (III).
Ионы Fe2+ и Fe3+ легко образуют комплексные соединения. Это свойство широко используется не только для открытия, но и для маскировки ионов Fe3+.
Элементы пятой аналитической группы имеют переменную степень окисления (кроме магния) и поэтому для них характерны окислительно-восстановительные реакции. Это свойство используется для открытия ионов Мn2+(окисление до фиолетового иона МnО4-).
Свежеосажденные сульфиды и гидроксиды элементов пятой аналитической группы аморфны и способны довольно легко переходить в коллоидное состояние. Это происходит в том случае, когда при определенных условиях рост частиц труднорастворимого соединения задерживается и образуются так называемые коллоиде частицы. Таким образом, труднорастворнмое соединение не выпадает в осадок, а образует коллоидный раствор, занимающий промежуточное положение между грубыми суспензиями (взвесями) и истинными растворами.
Если в коллоидный раствор добавить избыток какого-либо электролита, происходит процесс коагуляции: образующиеся крупные частицы уже не могут удерживаться во взвешенном состоянии и начинают быстро оседать. Коагуляции также способствует повышение температуры. Склонность сульфидов и гидроксидов образовывать коллоидные растворы усложняет анализ, так как коллоидные частицы не могут быть отделены центрифугированием.
Поэтому осаждение необходимо вести в условиях, способствующих разрушению коллоидных частиц, т. е. при нагревании раствора и прибавлении к нему электролита. Промывать такие осадки надо горячей водой с небольшим количеством электролита (обычно добавляют хлорид или нитрат аммония). Если этого не сделать, то при промывании водой электролит с осадка полностью удаляется и частицы осадка вновь образуют коллоидный раствор.
Железо, марганец и магний относятся к элементам, необходимым для жизнедеятельности организма человека. Железо входит в состав гемоглобина и ряда ферментов. Большая часть железа содержится в гемоглобине эритроцитов, часть находится в печени в соединении с белком. Марганец участвует в обмене углеводов. Количество магния в природной воде определяет ее жесткость. Соли магния необходимы для питания растений, так как магний входит в состав хлорофилла. Магний содержится в теле человека, в основном в костной ткани, и, кроме того, регулирует работу сердца.
В медицине нашли применение перманганат калия КМnО4, раствор которого используется как антисептическое средство. Препараты железа применяют при анемии. Соединения магния употребляются как антацидные средства. Сульфат магния используется в качестве слабительного, успокаивающего и спазмолитического средства.
Частные реакции катионов пятой аналитической группы
Реакции катиона железа (II) Fe2+
1. Гидроксиды щелочных металлов NaOH и КОН количественно осаждают гидроксид железа (II) бледно-зеленого цвета:
FeSO4 + 2KOH → Fe(OH)2↓
Fe2+ + 2OH- → Fe(OH)2↓
Гидроксид растворяется в кислотах, но не растворяется в щелочах
При стоянии на воздухе осадок быстро буреет вследствие окисления до гидроксида железа (III):
4Fe(OH)2 + О2 + 2Н2О → 4 Fe(OH)3↓
2. Гексацианоферрат (III) калия Кз[Fе(СN)6] выделяет темно-синий осадок турнбулевой сини:
3FeS04 + 2K3[Fe(CN)6] → Fе3[Fе(СN)6] 2 + 3K2SO4
3Fe2+ + 2[Fe(CN)6]3- → Fе3[Fе(СN)6]2
Осадок практически нерастворим в кислотах, но разлагается щелочами. Это самая чувствительная реакция на соли железа (II). Для подавления гидролиза солей железа реакцию проводят в кислой среде. Избытка реактива следует избегать, так как его желтая окраска придает осадку зеленоватый оттенок. Реакция является фармакопейной.
3. Сульфид аммония (NH4)2S количественно осаждает железо (II) в виде сульфида железа (II) черного цвета:
FeSO4 + (NH4)2S → FeS↓ + (NH4)2SO4
Fe2+ + S2-→FeS↓
Осадок растворяется в кислотах. Данная реакция является фармакопейной.
Реакции катиона железа (III) Fe3+
1. Гидроксиды щелочных металлов и аммиак выделяют бурый студенистый осадок гидроксида железа (III):
FeCl3 + ЗКОН → Fe(OH)3↓+ 3KC1
Fe3+ + ЗОН- → Fe(OH)3↓
Гидроксид железа (III) растворяется в кислотах, но не растворяется в избытке щелочей.
2. Роданид калия KSCN дает с раствором соли железа (III) в слабокислой среде кроваво-красное окрашивание вследствие образования железо-роданистых комплексов. Реакция применяется для качественного и количественного определения Fe(III). Упрощенное уравнение может быть записано следующим образом:
FeCl3 + 3KSCN → Fe(SCN)3 + 3KC1
Fe3+ + 3SCN- → Fe(SCN)3.
Реакция обратима, поэтому для повышения ее чувствительности реактив должен быть взят в избытке. Реакция фармакопейная.
3. Гексацианоферрат (II) калия K4 Fe(CN)6] осаждает из нейтральных или кислых растворов солей железа (III) берлинскую лазурь - осадок интенсивного синего цвета:
4FeCl3 + 3K4[Fe(CN)6] → Fe4[Fe(CN)6]3↓ + 12КС1
4Fe3+ + 3[Fe(CN)6]4- → Fе4[(CN)6]3↓
В кислотах осадок заметно не растворяется, щелочи его разлагают. Реакция очень чувствительна и поэтому обычно применяется для определения Fe3+ в анализируемых растворах.
4. Сульфид аммония (NH4)2S, прибавленный к раствору солям железа (III), дает черный осадок сульфида железа (III):
2FeCl3 + 3(NH4)2S → Fe2S3↓ + 6NH4CI
2Fe3+ + 3S2- → Fe2S3 ↓
Этот осадок растворяется в кислотах.
5. Иодид калия или натрия окисляется солями железа (III) в кислой среде до свободного йода.
2FeCl3 + 2KI → 2FeCl2 + 2КС1 + I2.
Выполнение реакции. На фильтровальную бумагу наносят последовательно по одной капле растворов FeСl, НС1 и KI. Наблюдают появление бурого пятна. При добавлении 1 капли крахмала пятно становится темно-синим.
6. Реакция с сульфосалициловой кислотой. Катион Fe3+ реагирует в водных растворах с сульфосалициловой кислотой с образованием окрашенных комплексов. Наиболее устойчив комплекс желтого цвета. Точное строение комплексов в растворе неизвестно.
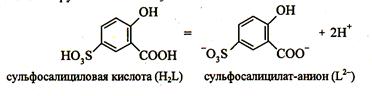 |
Реакции катиона Вi3+
Соли висмута (Ш) гидролизуются в водных растворах с образованием осадков малорастворимых оксосоединений - солей висмутила, формально содержащих катион висмутила ВiО+(например, BiOCl, ВiONОз и др.). Если соль висмута (Ш) растворить в воде, то получают мутный раствор вследствие образования частиц продуктов гидролиза. для подавления гидролиза и получения прозрачных растворов соль висмута (Ш) растворяют не в чистой воде, а в растворах кислот, чаще всего - в растворе HCl, в котором висмут (Ш) присутствует в форме хлоридных комплексов [ВiСl6]З-. На практике обычно используют солянокислые растворы хлорида висмута(Ш).
1. Реакции с щелочами и аммиаком. При.прибавлении растворов щелочей или аммиака к раствору соли висмута(Ш) выпадает белый осадок гидроксида Вi(ОН)3:
[ВiСI6]З+ + 3ОН- → Вi(ОН)3 + 6Cl-
Осадок растворяется в минеральных кислотах. При нагревании белый осадок Вi(ОН)3 желтеет вследствие образования оксогидроксида висмута (Ш) ВiO(ОН) (гидроксида висмутила):
Вi(ОН)3 → ВiO(ОН) + Н2О
2. Реакция гидролиза. Разбавление водой растворов солей висмута (Ш) приводит к их гидролизу с выделением белого осадка оксохлорида висмута BiOCl (хлорида висмутила):
[ВiСl6]3- + Н2О = ВiOСl + 2НСl+ЗСl-
При прибавлении раствора HCl и нагревании осадок растворяется (обратная реакция). Осадок оксохлоридависмута (Ш) не растворяется в растворах винной кислоты и ее солей.
3. Реакция с сульфид-ионами (фармакопейная). Висмут (Ш) при реакции с сульфид - ионами в кислой среде образует черно-коричневый осадок сульфида висмута (Ш) Вi2Sз:
2[ВiС l6]3- + 3S2- → Вi2S3 + 12Cl-
Осадок не растворяется в разбавленных минеральных кислотах, за исключением разбавленной НNОз, в которой он растворяется с выделениемсвободной серы:
Вi2S3 + 8НNОз → 2Вi(NОз)з + 2NO + 2S + 4Н2О
Осадок сульфида висмута растворяется в присутствии хлорида железа(Ш) FеСlз - также с выделением свободной серы:
Вi2Sз + 6FеСlз → 2ВiСlз + 6FeCl2 + 3S
4. Реакция с иодидами (фармакопейная). При прибавлении растворов иодидов к кислым растворам висмута (Ш) выпадает черный осадок иодида висмута (Ш) ВiI3, растворимый в избытке реагента с образованием желто- оранжевого раствора, содержащего тeтpаиодовисмутат (Ш)-ионы:
[ВiС l6]3- +3I- → ВiI3 +6Cl-
ВiI3 + 3I- →[ВiI4]-
Разбавление полученного раствора водой приводит к выпадению осадка ВiI3 с последующим его гидролизом и образованием желто-оранжевого оксоиодида висмута BiOI (иодида висмутила). Суммарно реакцию гидролиза можно описать схемой:
[ВiI4]-+ Н2О=ВiOI+3I- +2Н+
5. Реакция восстановления висмута (Ш) до висмута(0) соединениями олова (П). В щелочной среде (рН ≈10) олово (П) восстанавливает висмут(IП) до металлического висмута(0), выделяющегося в виде черного осадка. Олово (П) при этом окисляется до олова(IV):
2Вi(ОН)з + З[Sn(OН)4 ]2- → 2Bi + З[Sn(OН)6]2-
При большом избытке щелочи и нагревании выпадает также черный осадок металлического олова вследствие протекания реакции диспропорционирования:
2[Sn(OH)4]2- → [Sn(OН)6]2- +Sn+2OH-
При недостатке щелочи может выпасть черный осадок оксидаолова (II) SnO:
[Sn(OН)4]2- → SnO+2OH- +2Н2О
Реакции катиона марганца (II) Мn2+
1. Гидроксиды щелочных металлов NaOH и КОН с солями марганца (II) дают белый осадок гидроксида марганца (II):
MnSO4 + 2КОН → Mn(OH)2↓ + K2SO4
Mn2+ + 2ОН- → Mn(OH)2↓
Осадок быстро буреет на воздухе вследствие окисления кислородом воздуха до MnО(OH)2 (Н2МnОз)
2Mn(OH)2↓ + О2 → 2MnО(OH)2↓
Осадок растворим в разбавленных растворах сильных кислот и в насыщенном растворе хлорида аммония:
Mn(OH)2 + 2Н+ → Mn2+ + 2H2О
Mn(OH)2↓ + 2NH3Cl → Mn2+ + 2NH3? H2О + 2Cl-
2. Пероксид водорода Н2О2 в щелочной среде окисляет соли марганца (II) до темно-бурого осадка Н2МnО3 или МnО(ОН)2:
MnSO4 + Н2О2 + 2NaOH → МnО(ОН)2↓ + Na2SO4 + Н2О
Мn2+ + Н2О2 + 2ОН- → МnО(ОН)4 + Н2О.
Бромная вода оказывает такое же действие. В отличие от Мn(ОН)2 осадок МnО(ОН)2 не растворяется в разбавленной серной кислоте.
3. Диоксид свинца РbО2 в присутствии концентрированной азотной кислоты при нагревании окисляет Мn(II) до МnО4- с образованием марганцевой кислоты малинового цвета:
2MnSO4 + 5РbО2 + 6HNO3 → 2HMnO4 + 2PbSO4 + 3Pb(NO3)2 + 2H2O
2Mn2+ + 5РbO2 + 4H+ → 2MnO4-+ 5Pb2++ 2H2O
Эта реакция дает отрицательные результаты в присутствии восстановителей, например хлороводородной кислоты и ее солей, так как они взаимодействуют с диоксидом свинца, а также с образовавшейся марганцевой кислотой.
При больших количествах марганца эта реакция не удается, так как избыток ионов Мn2+ восстанавливает образующуюся марганцевую кислоту НМnО4 до МnО(ОН)2 и вместо малиновой окраски появляется бурый осадок. Вместо диоксида свинца для окисления Мn2+ в МnО4- могут быть использованы другие окислители, например персульфат аммония (NH4)2S2O8 в присутствии катализатора ионов Ag+ или висмутат натрия NaBiO3:
2MnSO4 + 5NaBiO3 + 16HNO3 = 2HMnO4 + 5Bi(NO3)3 +NaNO3 + 2Na2SO4 +7H2O
Выполнение реакции. В пробирку вносят стеклянным шпателем немного РbСl, а затем 5 капель концентрированной азотной кислоты НNО3 и нагревают смесь на кипящей водяной бане. В нагретую смесь добавляют 1 каплю раствора сульфата марганца MnSO4 и снова нагревают 10—15 мин, встряхивая время от времени содержимое пробирки. Дают избытку диоксида свинца осесть и наблюдают малиновую окраску образовавшейся марганцевой кислоты.
При окислении висмутатом натрия реакцию проводят следующим образом. В пробирку помещают 1—2 капли раствора сульфата марганца (II) и 4 капли 6 моль/л HNO3, добавляют несколько крупинок висмутата натрия и встряхивают. Наблюдают появление малиновой окраски раствора.
4. Сульфид аммония (NH4)2S, прибавленный к раствору солям марганца (II), дает розово- телесный осадок сульфида марганца (II):
Mn2+ + S2- → MnS ↓
Этот осадок растворяется в разбавленных кислотах.
Реакции катиона магния Mg2+
1. Гидроксиды щелочных металлов NaOH, KOH осаждают белый студенистый осадок гидроксида магния:
MgCl2 + 2 KOH → Mg(OH)2 ↓ + 2KCl
Mg2++ 2 OH- → Mg(OH)2 ↓
в присутствии аммонийных солей осаждение не может быть полным. При высокой концентрации солей аммония осадок Mg(OH)2 может совсем не образовываться, так Mg(OH)2 как растворяется в избытке аммонийных солей:
2. Гидрофосфат натрия Na2HPO4 является характерным реактивом на магний. В растворах солей магния, содержащих хлорид аммония, в присутствии аммиака образуется белый мелкокристаллический осадок аммония- магния - фосфат
MgCl2 + NaHPO4 + NH4OH → NH4MgPO4↓ + 2NaCl + H2O
Mg2+ + PO4 3- + NH4+ → NH4MgPO4↓
Эта реакция — важнейшая качественная реакция на ион является фармакопейной. Реакцию нельзя проводить в присутствии остальных катионов пятой группы.
Гидрофосфат натрия является хорошим реактивом для микрокристаллоскопической реакции. На предметное стекло помещают по одной капле растворов соли магния, аммиака и хлорида аммония. Смешивают эти капли. Рядом с этой смесью помещают 1 каплю раствора Na2HPO4 и соединяют их стеклянной палочкой, потирая по стеклу. Выпавшие кристаллы рассматривают под микроскопом
3. 8-Оксихинолин HC9H6NO. Катионы Mg2+ с 8-Оксихинолином образуют в аммиачной среде при рН≈8-13 (лучше - при нагревании)
зеленоватожелтый кристаллический осадок оксихинолята магния:
2HC9H6NO + MgCl2 → Mg(C9H6NO)2↓+ 2HC1
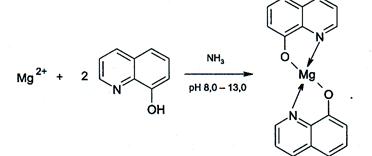
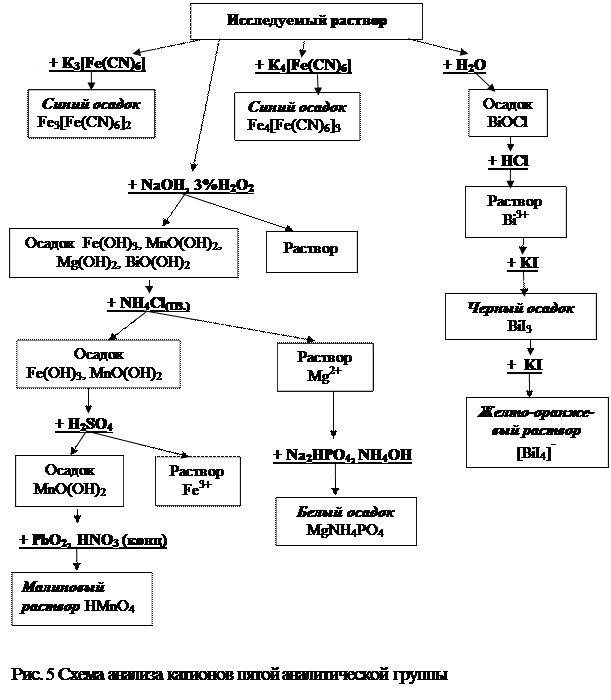
Схема анализа катионов пятой аналитической группы представлена на рисунке 5
 2014-02-02
2014-02-02 59832
59832








