| Номер группы | Анионы | Групповой реагент | Характеристика группы |
| I | SO42- (сульфат- ион) SO32- (сульфит -ион) S2O32- (тиосульфат-ион) CO32- (карбонат-ион) PO43- (фосфат-ион) BO2- (борат-ион)или B4O72- (тетраборат-ион) CrO4 2- (хромат-ион) или Cr2O72- (дихромат) C2O42- (оксалат-ион) | BaCl2 в нейтральном или слабощелочном растворе | Соли бария малорастворимые в воде |
| II | Cl- (хлорид-ион) Br- (бромид-ион) I- (йодид-ион) S2- (сульфид-ион) | AgNO 3 в присутствии 2моль/л HNO3 | Соли серебра малорастворимы в воде и в разбаленной HNO3 |
| III | NO3- (нитрат-ион) NO2- (нитрит-ион) CH3COO- (ацетат-ион) | Группового реагента нет | Соли бария и серебра растворимы в воде |
Общепринятого систематического хода анализа анионов не имеется. В отличие от анализа катионов при анализе анионов наиболее целесообразно оказывается непосредственное обнаружение отдельных анионов без предварительного разделения. Эта возможность обусловлена тем, что анионы большей частью не мешают открытию друг друга. В соответствии с этим групповые реактивы применяются не для разделения групп, а для их обнаружения.
При выполнении частных реакций на анионы необходимо иметь в виду, что внешний вид осадков многих ионов, полученных с бариевыми или серебряными солями, одинаков. Поэтому особое внимание следует уделять характеру и степени растворимости тех или иных осадков в кислотах или других реактивах. Растворимым в данной кислоте мы считаем такой осадок, который, будучи полученным, из 2—3 капель раствора, растворяется при добавлении нескольких капель разбавленной кислоты без остатка или с очень незначительным остатком. Но если при добавлении примерно 10 капель кислоты или другого реактива растворения не наступает или не происходит заметного просветления раствора, осадок считается нерастворимым.
Частные реакции анионов первой аналитической группы
К первой группе анионов относятся анионы SO42-, CO32-, SO32--, S2O32-, BO2-, B4O72- и C2O42-.
Групповым реагентом как было сказано выше иявляется ВаСl2 в нейтральной или слабощелочной среде, так как труднорастворимые бариевые соли этих анионов, за исключением BaSO4, растворимы в кислотах.
Ион Ag+ образует с анионами данной группы (кроме SO42-) труднорастворимые в воде соли, легко растворяющиеся в разбавленной азотной кислоте. Все анионы данной группы бесцветны.
Для организма человека большое значение имеют фосфаты и карбонаты. Фосфатные и гидрокарбонатные буферные смеси поддерживают определенную величину рН внутренней среды живого организма.
Наличие карбонатов и сульфатов в питьевой воде определяет ее бытовые и вкусовые качества. Кроме того, присутствие сульфатов неминерального происхождения является показателем санитарного загрязнения воды (например, сточными водами).
В качестве лекарственных веществ используют сульфат магния (слабительное и гипотензивное средство), гидрокарбонат натрия (при желудочных заболеваниях), борную кислоту и тиосульфат натрия (антисептические средства).
Реакции сульфат-иона SO42-
Сульфат-ион является анионом серной кислоты — сильного электролита. В водных растворах бесцветен, практически не гидролизуется, обладает окислительно-восстановительными свойствами.
1. Хлорид бария ВаС12 осаждает из разбавленных растворов сульфатов белый осадок сульфата бария:
ВаС12 + Na2SO4 → BaSO4↓+ 2Na2SO4
Ва2+ + SO42- → BaSO4↓
Осадок не растворяется в кислотах и гидроксидах щелочных металлов. За исключением концентрированной серной, в котрой он заметно растворяется с образованием гидросульфата бария:
BaSO4 + H2SO4 → Ba(НSO4)2
Реакция является фармакопейной.
2. Ацетат и нитрат свинца (II) осаждают из растворов сульфатов белый осадок сульфата свинца (II):
Pb(NO3)2 + Na2SO4 → PbSO4↓ + 2NaNO3
Pb2+ + SO4 2-→ PbSO4 ↓
Осадок не растворяется в азотной кислоте и с трудом растворяется при нагревании в растворах щелочей (в отличие от осадков сульфатов кальция, стронция и бария), а также в концентрированном 30 % растворе ацетата аммония:
РbSО4+ 4КОН → К2[Pb (ОН)4] + K2SO4
Растворяется также в концентрированной серной кислоте:
РbSО4+ H2SO4 → Pb(ОНSO4)2
Реакции фосфат-иона PO43-
Фосфат-ион PO43- является анионом ортофосфорной кислоты НзРO4 - кислоты средней силы.
1. Хлорид бария ВаС12 выделяет из нейтральных растворов белый аморфный осадок гидрофосфата бария:
Na2HPO4 + ВаС12 → ВаНРО4↓+ 2NaCl
НРО32-+ Ва2+ → ВаНРО4↓
Свежеосажденный садок растворим в минеральных кислотах (кроме серной) и в уксусной кислоте.
Если проводить реакцию в слабощелочной среде или с раствором соли BазРО4, выделяется осадок Ва3(РО4)2:
ЗВа2+ + 2РО43- → Ba3(PО4)2↓
2. Магнезиальная смесь (водный раствор аммиака, хлорида аммония и хлорида магния) выделяет даже из разбавленных растворов белый кристаллический осадок фосфата магния-аммония:
Na2HPO4 + MgCl2 + NH4OH → NH4MgPO4↓ + 2NaCl + H2O
HPO42- + Mg2+ + NH4OH → NH4MgPO4↓ + H2O.
Осадок легко растворим даже в очень слабых кислотах. Эта реакция является характерной для PO43- и применяется для обнаружения фосфатов в моче. Реакция является фармакопейной.
3. Нитрат серебра AgNO3 дает с фосфатом-ионом желтый осадок фосфата серебра, легко растворимый в азотной кислоте и в растворе аммиака. Полное осаждение возможно только в нейтральной или щелочной среде:
Na3PO4 + 3AgNO3 → Ag3PO4↓+ 3NaNO3
PO43- + 3Ag+ → Ag3PO4↓
Реакция является фармакопейной.
4. Молнбдат аммония (NH4)2MoO4, прибавленный в избытке, осаждает из азотнокислого раствора гидрофосфата желтый кристаллический осадок:
Na2HPO4 + 12(NH4)2MoO4 + 23HNO3 → (NH4)3H4[P(Mo2O7)6]↓
+ 21NH4NO3 + 2NaNO3 + 10H2O
HPO42- + 3NH4+ + 12MoO42- + 23H+ →(NH4)3H4[P(Mo2O7)6]↓+ 10H2O
Осадок легко растворим в щелочах и в растворе аммиака, азотной кислоте. Кроме того, осадок растворяется в избытке фосфата щелочного металла. Ионы SO32- и S2O32- (и другие ионы-восстановители) мешают реакции, так как они восстанавливают MoO42- до молибденовой сини. Реакция очень чувствительна и характерна для иона РО43-; применяется для обнаружения фосфатов в моче. Данная реакция является фармакопейной.
Реакции карбонат-иона СО32-
Карбонат-ион является анионом угольной кислоты. Эта кислота в свободном состоянии не встречается, так как почти полностью распадается на СO2 и воду. Н2СО3 - очень слабая кислота и ее аммонийные соли и соли щелочных металлов в значительной степени подвергаются гидролизу.
1. Хлорид бария ВаСl2 из растворов карбонатов осаждает на холоду белый осадок карбоната бария:
ВаСl2 + Na2CO3 → ВаСО3↓+ NaCl
Ва2+ + СО32-→ ВаСО3↓
Осадок легко растворим в разбавленных кислотах: хлороводородной, азотной и в уксусной. При кипячении или при стоянии он становится кристаллическим и более плотным.
2. Кислоты разлагают все карбонаты с бурным выделением оксида углерода (IV):
Na2CO3 + 2HC1 → 2NaCl + CO2↑
CO32-+ 2H+ → H2O + CO2↑
Эта реакция очень характерна для карбонатов, так как выделение SO2 при разложении сульфитов кислотами протекает не так бурно. Реакция является фармакопейной. Выдающийся углекислый газ обнаруживают по помутнению баритовой или известковой воды в приборе для обнаружения газов.
3. Нитрат серебра AgNO3 из растворов карбонатов осаждает карбонат серебра — осадок белого цвета:
2AgNO3 + Na2CO3 → Ag2 CO3↓ + 2NaNO3
2Ag+ + CO3 2- → Ag2 CO3↓
Карбонат серебра легко растворим в разбавленной азотной кислоте и растворе аммиака. При растворении в кислоте наблюдается интенсивное выделение оксида углерода (IV). При нагревании происходит почти полный гидролиз карбоната серебра. В осадке остается оксид серебра грязно-коричневого цвета.
4. Реакция с сульфатом магния. Реакция является фармакопейной. Карбонат – ион с сульфатом магния образует белый осадок:
Мg2+ + CO3 2 -→ МgCO3↓
Осадок растворим в кислотах.
Гидрокарбонат – ион с сульфатом магния образует белый осадок только при кипячении:
Мg2+ + 2НCO3 2-→ МgCO3↓ + CO2+ H2O
Реакции на сульфит – ион SO32-
Сульфит – ион – анион сернистой кислоты. Сернистая кислота является нестойкой кислотой и в свободном состоянии она частично разлагается на SO2 и воду. В водных растворах сульфиты постепенно окисляются в сульфаты.
1 Хлорид бария В аС12 из нейтральных растворов сульфитов выделяет белый осадок сульфита бария:
ВаС12 + Na2SO3 → BaSO3↓+ 2NaCl
Ва2+ + SO32- → BaSO3↓
Осадок растворим в разбавленных хлороводородной и азотной кислотах:
BaSO3+ 2 HCl → SO2+ BaCl2+ H2O
Реакция является фармакопейной.
2. Нитрат серебра AgNO3 выделяет из нейтральных растворов сульфитов белый кристаллический осадок сульфита серебра:
Na2SO3 -+ 2AgNO3 → Ag2SO3↓+ 2NaNO3
SO32-+ 2Ag+ → Ag2SO3↓.
Осадок растворим в разбавленной азотной кислоте и в растворе аммиака. В избытке раствора сульфита щелочного металла он растворяется с образованием комплексной соли:
Ag2SO3 + 3Na2SО3 → 2Na3[Ag(SO3)2]
3. Раствор иода I2 при действии на сернистую кислоту (а) или подкисленные растворы сульфитов (б) обесцвечивается:
H2SO3 + I2 + Н2О → 2HI + H2SO4 (a)
или
Na2SO3 + 2НС1 + I 2 + Н2О → 2HI + H2SO4 + 2NaCl (б)
Реакцию следует проводить в слабокислой среде, так как в щелочном растворе иод обесцвечивается и в отсутствие сульфитов. Реакция очень чувствительна. Реакция является фармакопейной.
4. Реакция разложения минеральными кислотами. Реакция является фармакопейной. Все сульфиты разлагаются минеральными кислотами с выделением газообразного диоксида серы:
Na2SO3 + 2НС1 → SO2↑ + Н2О + 2NaCl
SO32- + 2Н+ → SO2↑ + Н2О
Выделившийся газ обнаруживают по характерному запаху, а также по обесцвечиванию водного раствора йода или перманганата калия.
5. Нитропруссид натрия Na2[Fe(CN)5NO] окрашивает нейтральные растворы сульфитов в розово-красный цвет. При действии избытка сульфата цинка окраска становится ярко-красной. Чувствительность реакции повысится, если добавить немного гексацианоферрата (II) калия K4[Fe(CN)6] — образуется красный осадок.
Реакции тиосульфат-иона S2O32-
Тиосульфат-ион S2O32- - анион тиосерной кислоты H2S2Оз. Тиосерная кислота неустойчива и в свободном виде не существует. Соли щелочных металлов этой кислоты устойчивы, однако в водных растворах подвергаются гидролизу. Тиосульфаты являются сильными восстановителями.
1. Хлорид бария ВаС12 с тиосульфат-ионом образует белый осадок тиосульфата бария:
Na2S2O3 + BaCl2 → ВаS2Оз↓ + 2NaCl
S2O32- + Ba2+→ ВаS2Оз↓
Осадок растворяется в кипящей воде и в разбавленных минеральных кислотах (кроме серной). ВаS2Оз легко образует пересыщенный раствор. Для ускорения выпадения осадка можно потереть внутреннюю стенку пробирки стеклянной палочкой.
2. Минеральные кислоты вытесняют тиосерную кислоту из ее солей:
Na2S2O3 + 2HC1 → H2S2O3 + 2NaCl.
Тиосерная кислота в момент образования разлагается:
H2S2O3 → S↓ + SO2↑+ Н2О
Образовавшаяся сера вызывает помутнение раствора. Эта реакция позволяет обнаружить тиосульфаты в присутствии сульфитов, так как сернистая кислота при разложении выделяет только SO2, а серы не образуется. Реакция является фармакопейной.
3. Нитрат серебра AgNO3 образует с растворимыми тиосульфатами белый осадок, который быстро становится желтым, затем бурым и, наконец, черным вследствие перехода в сульфид серебра:
Na2S2O3 + 2AgNO3 → Ag2S2O3↓+ 2NaNO3
Ag2S2O3 + H2O → Ag2S↓ + H2SO4.
Осадок тиосульфата серебра Ag2S2O3 растворим в избытке тиосульфата натрия с образованием комплексных ионов [Ag(S2O3)2]3-. Поэтому при проведении этой реакции необходимо добавлять избыток AgNO3. Реакция характерна для тиосульфат-иона и является фармакопейной.
4.Реакция с йодом. Тиосульфат – ион обесцвечавает нейтральные или слабощелочные растворы йода, восстанавливая йод до йодид – ионов с одновременным образованием тетратионат – иона:
2Na2S2O3 + I2 → 2NaI +Na2S4O6
Реакции борат-ионов ВО2- и В4О72-
Ортоборная кислота НзВО3 — бесцветное, твердое кристаллическое вещество, относится к очень слабым электролитам. Соли борной кислоты отвечают по составу не ортоборной кислоте НзВОз, а метаборной кислоте НВO2 или тетраборной кислоте Н2В4О7.
1. Хлорид бария ВаС12 с концентрированными растворами буры дает белый осадок метабората бария, который растворяется в уксусной, хлороводородной и азотной кислотах.
Na2B4O7 + ВаС12 + ЗН2О → Ba(BO2)2↓ + 2НзВО3 + 2NaCl
В4О72- + Ва2+ + ЗН2О → Ba(BО2)2 + 2НзВО3.
2. Этиловый спирт и концентрированная серная кислота при взаимодействии с сухой борной кислотой или сухим тетраборатом образуют борноэтиловый эфир, который пи горении дает пламя с ярко- зеленой окраской.
Na2B4O7 + Н2 SО4 5 H2O → 4НзВО3 + Na2SO4
H3BO3 + 3C2H5OH → B(C2H5O)3 + 3H2O
Является фармакопейной.
3. Куркумовая бумага, смоченная подкисленным раствором бората или борной кислоты, после высыхания дает буровато – розовое окрашивание. После смачивания бумаги раствором аммиака или щелочи наблюдается появление зеленовато- черного окрашивания. Реакция очень характерна и является фармакопейной
Реакции оксалат-иона С2O42-
Оксалат-ион является анионом щавелевой кислоты Н2C2O4. – кислоты средней силы. Это твердая, хорошо растворимая в воде кислота, слабый электролит.
1. Хлорид бария ВаСl2 с анионом образует белый осадок оксалата бария:
(NH4)2C2O4 + BaCI2 → ВаС2O4↓ + 2NH4C1
C2O42- + Ba2+ → ВаС2O4↓
Осадок растворим в хлороводородной и азотной кислотах и в уксусной при нагревании.
2. Хлорид кальция CaCl2 образует с оксалат-ионами белый кристаллический осадок оксалата кальция, который растворяется в минеральных кислотах и не растворяется в уксусной кислоте.
(NH4)2C2O4 + CaCI2 → CаС2O4↓ + 2NH4C1
C2O42- + Ca2+ → CаС2O4↓
Реакция характерна для оксалат-иона.
3. Реакция с нитратом серебра. Оксалат – ион при взаимодействии с катионом серебра образует белый творожистый осадок:
C2O42- + 2 Ag+ → Ag2С2O4↓
Осадок растворим в азотной кислоте, концентрированном растворе аммиака.
4. Перманганат калия КМnО4 окисляет в кислой среде оксалат-ион до оксида углерода (IV). При этом ионы МпО4- восстанавливаются до бесцветных ионов Мn2+ и раствор обесцвечивается:
5(NH4)2C2O4 + 2КМnО4 + 8H2SO4 → 10CO2↑+ 2MnSO4 + K2 SO4 + 5(NH4)2SO4 + 8H2O
2МnO4- + 16Н+ + 5C2O42- → 2Mn2++ 8H2O + 10CO2
Выполнение реакции. К 4 каплям оксалата аммония прибавляют 5 капель серной кислоты, смесь нагревают до 70 — 80 °С. К полученному горячему раствору по каплям добавляют разбавленный раствор перманаганата калия и наблюдают обесцвечивание раствора.
Частные реакции анионов второй аналитической группы
Ко второй группе анионов относятся анионы С1-, Вг-, I-, S2-. Эти анионы образуют с ионами серебра труднорастворимые в воде и нерастворимые в разбавленной азотной кислоте соли. Групповым реагентом является AgNO3 в присутствии разбавленной азотной кислоты. В этих условиях AgNO3 не образует осадка с анионами первой группы. Бариевые соли анионов второй группы растворимы в воде.
Для организма большое значение имеют хлориды. Хлориды натрия и калия поддерживают осмотическое давление в клетках. Хлориды определяют вкусовые качества воды. Недостаток иода в организме приводит к нарушению деятельности щитовидной железы. Длительное употребление питьевой воды с избытком или недостатком иодидов может служить причиной эндокринных заболеваний.
Хлориды натрия, калия и кальция широко применяются как инъекционные растворы. Бромиды калия и натрия применяются в составе микстур в качестве успокаивающих средств, хлорид калия — при нарушении сердечного ритма. Свободный иод применяется в растворах как антисептическое средство, а также при атеросклерозе и заболеваниях щитовидной железы.
Хлорид-ион С1- является анионом хлороводородной кислоты. Это одна из самых сильных кислот: ее соли, образованные катионом сильного основания, не подвергаются гидролизу. Большинство хлоридов хорошо растворимы в воде, труднорастворимы хлориды серебра, ртути (I) и свинца (II).
1. Нитрат серебра AgNO3 с ионом Сl- дает белый творожистый осадок хлорида серебра:
NaCl + AgNO3 → AgCl↓+ NaNO3
Ag+ + Cl- →AgCl↓
Осадок нерастворим в азотной кислоте, но легко растворяется в аммиаке с образованием комплексного соединения:
AgCl + 2NH3 → [Ag(NH3)2]Cl
При прибавлении к раствору хлорида диамминсеребра концентрированной азотной кислоты осадок снова выделяется:
[Ag(NH3)2]Cl + 2HNO3 → 2NH4 NO3 + AgCl↓
Осадок хлорида серебра легко растворим также в тиосульфате натрия Na2S2O3 (см. реакции тиосульфат-иона). Реакция является фармакопейной.
Осадок при стоянии на свету темнеет вследствие выделения тонкодисперсного металлического серебра за счет фотохимического разложения хлорида серебра.
Реакции бромид-иона Вг-
Ион Вг- является анионом бромоводородной кислоты НВг, По своим свойствам и растворимости бромиды близки к хлоридам.
1. Нитрат серебра АgNОз с ионами Вг- дает желтовато-белый осадок бромида серебра:
NaBr + AgNO3 → AgBr↓+ NaNO3
Ag++ Br- → AgBr↓
Осадок не растворяется в азотной кислоте, плохо растворим в аммиаке, в отличие от хлорида серебра и хорошо растворяется в растворе тиосульфата натрия:
AgBr + 2Na2S2O3 → NaBr + Na3[Ag (S2O3)2]
Реакция является фармакопейной.
2. Хлорная вода, прибавленная к раствору бромида, выделяет из него свободный бром, который растворяется в сероуглероде или хлороформе, окрашивая слой растворителя в оранжевый цвет:
Сl2 + 2NaBr → 2NaCl+ Вг2.
Эта реакция наиболее характерна для иона Вг- и является фармакопейной.
В качестве окислителей можно использовать KMnO4, MnO2, RBrO3, NaClO и другие.
10Br- + 2MnO4- + 16Н+→5Br2 + 2Mn2+ + 8Н2О
5Br- + BrO3- + 6Н+ → 3Br2 + 3Н2О
Реакции иодид -иона I-
Ион I- является анионом иодоводородной кислоты. Эта кислота такая же сильная, как НСl и НВг. Из иодидов труднорастворимы в воде соли серебра, ртути, свинца (IV) и меди (I).
1. Нитрат серебра АgNОз выделяет из иодидов светло-желтый творожистый осадок иодида серебра:
KI + AgNО3 → AgI↓+ KNO3
I- + Ag+ → AgI↓
Осадок не растворяется в азотной кислоте и растворе аммиака и плохо растворяется в растворе тиосульфата натрия. Реакция является фармакопейной.
2. Нитрат или ацетат свинца (II) из растворов иодидов осаждает желтый иодид свинца (II), растворимый в горячей воде и вновь выделяющийся при охлаждении раствора в виде золотистых чешуек:
2KI + Рb(NОз)2 → РbI2↓ + 2KNO3
2I- + Рb2+ → РbI2↓
3. Хлорная вода выделяет из растворов иодидов свободный иод, который окрашивает сероуглерод или хлороформ в красновато-фиолетовый цвет, а раствор крахмала — в синий:
2KI + С12 → 2КС1 + I2.
Реакция характерна для иона I- и чаще всего применяется для его обнаружения.
4. Хлорид железа (III), концентрированная H2SO4 и некоторые другие окислители окисляют ион I- до свободного иода:
а) 2FеСl3 + 2КI → 2FeCI2 + 2КС1 + I2
б) 8HI + H2SO4 → 4Н2О + H2S + 4I2
Реакции являются фармакопейными.
Выполнение реакции: а) на фильтровальную бумагу в одном месте последовательно по 1 капле наносят растворы KI2 HC1 и FеС13. Наблюдают появление бурого пятна, синеющего от капли крахмала; б) в пробирку в вытяжном шкафу помещают несколько крупинок иодида, добавляют 3 капли концентрированной H2SO4, нагревают и наблюдают выделение фиолетовых паров иода.
Реакции сульфид-иона S2-
Ион S2- является анионом сероводородной кислоты, представляющей собой раствор сероводорода в воде. Это одна из самых слабых кислот. Ион S2- легко окисляется.
1. Нитрат серебра AgNO3 взаимодействует с ионом S2-, образуя черный осадок сульфида серебра:
Na2S + 2AgNO3 → Ag2S↓+ 2NaNO3
S2- + 2Ag+ → Ag2S↓
Сульфид серебра не растворяется в разбавленной азотной кислоте на холоду, но растворяется в ней при кипячении. В растворе аммиака не растворяется.
2. Хлороводородная кислота, прибавленная к раствору сульфида натрия, выделяет из него сероводород, легко обнаруживаемый по запаху тухлых яиц:
Na2S + 2HC1 → H2S↑+ 2NaCl.
S2- + 2H+ → H2S↑
Фильтровальная бумага, смоченная раствором ацетата свинца (II) РЬ(СН3СОО) 2, в присутствии сероводорода чернеет.(поднести к горлышку пробирки). Работать только под тягой!
3. Растворимые соли кадмия образуют с сульфидами ярко-желтый осадок сульфида кадмия:
Na2S + Cd(NO3)2 → CdS↓ + 2NaNO3.
Если на осадок подействовать раствором CuSO4, осадок почернеет вследствие образования CuS:
CdS + CuSO4 → CdSO4 + CuS↓
Реакция характерна для сульфид-иона.
Выполнение реакции. К З каплям раствора сульфида натрия добавляют 3 капли раствора соли кадмия. Центрифугируют и центрифугат сливают. К осадку добавляют 2—3 капли раствора сульфата меди (II). Наблюдают изменение ярко-желтой окраски раствора в черную.
Частные реакции анионов третьей аналитической группы
К третьей аналитической группе анионов относятся нитрит-ион NO2-, нитрат ион NO3- и ацетат-ион СН3СОО-. Серебряные и бариевые соли этих анионов растворимы в воде, вследствие чего ни AgNO3, ни ВаСl2 не осаждают анионы третьей группы. Группового реагента у этой группы нет.
Определение нитритов и нитратов имеет большое значение для исследования питьевой воды. Наличие большого количества нитритов и нитратов является показателем загрязнения и непригодности воды для питья.
Присутствие больших количеств нитритов и нитратов в овощах и фруктах является небезразличным для живых организмов, оно не должно превышать 40 мг/кг.
Органические производные азотной кислоты, например, нитроглицерин, используются как сердечно-сосудистые средства. Нитрит натрия и некоторые производные азотистой кислоты применяют при стенокардии. Определенные соли уксусной кислоты входят в состав различных лекарственных препаратов реакции нитрит-иона.
Реакции не нитрит – ион NO2-
Ион NO2- является анионом азотистой кислоты HNO2. Азотистая кислота нестойкая и слабая кислота. Нитриты устойчивее азотистой кислоты. Все они хорошо растворимы в воде. Менее других растворим нитрит серебра, но он легко растворяется при нагревании. Нитриты токсичны!
1. Разбавленная серная кислота разлагает все нитриты на холоду с выделением бурого газа — оксида азота (IV):
NaNO2 + H2SO4 → NaHSO4 + HNO2
2HNO2 → NO2↑+ NO↑ + H2O
2NO + O2 → 2NO2↑
Концентрированная серная кислота реагирует точно так же, как и разбавленная, но более энергично. Даже небольшое нагревание усиливает разложение азотистой кислоты. Реакция является фармакопейной.
2. Иодид калия KI в кислой среде окисляется нитритами до свободного иода (нитрит – ион- окислитель):
2KNO2 + 2KI + 2H2SO4 → I2 + 2NO↑ + 2K2SO4 + 2Н2O
2NO2- + 2I- + 4H+ → I2 + 2NO↑ + 2Н2O
Реакцию нельзя проводить в присутствии других окислителей. Образовавшийся йод обнаруживают реакцией с крахмалом (по посинению раствора) или экстрагируя его органическим растворителем (органический слой окрашивается в фиолетовый цвет).
3. Перманганат калия КМnO4 в сернокислой среде при нагревании до 50 — 60°С окисляет нитриты до нитратов:
5NaNO2 + 2КМnО4 + 3H2SO4 → 5NaNO3 + 2MnSO4 + К2SО4 + ЗН2О
5NO2- + 2МnО4 -+ 6H+ → 5NO3- + 2Mn2+ + ЗН2О
Реакция сопровождается обесцвечиванием раствора перманганата калия. При помощи этой реакции легко отличить нитриты от нитратов. Последние в реакцию с КМnО4 не вступают.
4. Соли железа (II) восстанавливают нитриты в кислом растворе до оксида азота (II):
2KNO2 + 2FeSO4 + 2H2SO4 → Fe2(SO4)3 + 2NO↑+ К2SО4 + 2H2O
Оксид азота (II) образует с FeSO4 непрочное комплексное соединение бурого цвета:
FeSO4 + NO → [Fe(NO)]SO4.
Выполнение реакции. В пробирку помещают 2 капли свежеприготовленного насыщенного раствора сульфата железа (II) FeSO4, подкисляют 1 каплей разбавленной серной кислоты и затем осторожно, по стенке пробирки, приливают раствор нитрита так, чтобы жидкость не смешивалась. В месте соприкосновения обеих жидкостей появляется темно-бурое окрашивание.
6. Антипирин образует с нитритами в кислой среде раствор изумрудно- зеленого цвета. Реакция является фармакопейной.
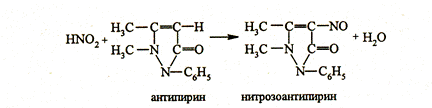 |
Реакции на нитрат – ион NO3-
Реакции не нитрат – ион NO3-
Ион является анионом азотной кислоты, одной из самых сильных минеральных кислот. Азотная кислота является довольно сильным окислителем. Все нитраты растворимы в воде.
1. Сульфат железа (II) окисляется азотной кислотой и ее солями с выделением оксида (II) NO реакция проходит в присутствии концентрированной серной кислоты
2NaNO3 + 6FeSO4 + 4H2SO4 → 3Fe2(SO4)3 + Na2SO4 + 2NO↑ 4H2O
Оксид азота(2) образует с бурое соединение
FeSO4 + NO↑ → [Fe(NO)]SO4
Несмотря на то, что вследствие реакции образуется то же самое соединение, что и при реакции на ион NO2-, мы можем различить эти ионы по тому, как протекает данная реакция. Если неизвестно, нитрат или нитрит находятся в растворе, необходимо сначала провести реакцию с разбавленной серной кислотой. Образующееся бурое соединение докажет наличие присутствие иона NO2-.
Если же реакция не пошла, что доказывает отсутствие ион NO2-, поэтому, необходимо повторить реакцию уже с концентрированной серной кислотой. Появление бурого кольца докажет присутствие ион NO3-
2.Дифениламин. В кислой среде окисляется азотной кислотой, что сопровождается появлением, интенсивно синей окраски.
Реакцию поводят на предметном стекле.
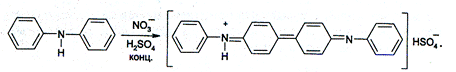 |
Эта общая реакция для нитрит - иона и нитрат – иона и проводится одинаково. Поэтому данной реакцией нельзя открыть нитраты в присутствии нитритов.
3.Реакция с металлической медью. Реакция фармакопейная. Нитрат – ион взаимодействует в среде концентрированной серной кислоты при нагревании ты с металлической медью с образованием буро-желтых паров оксида азота:
2NO3- + 8H++ Cu → 3Cu2++ 2NO + 4H2O
2NO + O2 → 2NO2↑
 2014-02-02
2014-02-02 4762
4762








