1. Сопряжение неподеленной электронной пары с двойной связью, находящейся в α-положении к карбанионному центру:
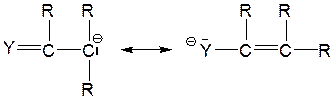
Этим объясняется стабильность КА аллильного и бензильного типа:
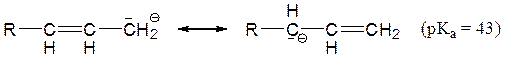
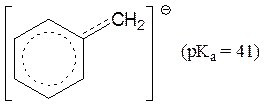
Еще более устойчивы дифенилметил-анион и трифенилметил-анион (рКа = 31.5). Эти анионы (в виде солей) могут сохраняться в растворах неопределенно долгое время в отсутствие влаги.
Еще более устойчивы карбанионы с кратной связью С=О, С=N или N=O, поскольку электроотрицательные атомы способны лучше удерживать отрицательный заряд. Однако является вопросом, можно ли такие анионы, например, енолят-анион, строго относить к числу карбанионов:
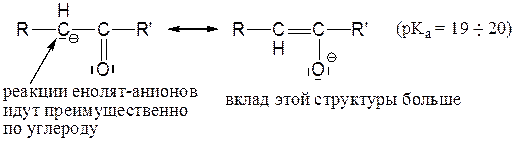
Анионы простых нитроалканов существуют даже в воде:
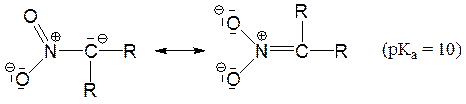
2. Повышение s-характера карбанионного центра:
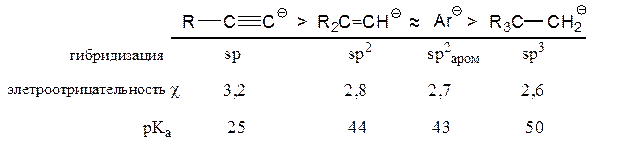
Увеличение s-характера означает, что электроны расположены ближе к углеродному ядру, и поэтому карбанион обладает меньшей энергией, т. е. более стабилен.
3. Стабилизация серой и фосфором, находящейся в α-положении по отношению к карбанионному центру, благодаря перекрыванию неподеленной электронной пары с вакантной d-орбиталью (2pπ-3dπ-сопряжение, pπ-dπ-сопряжение):
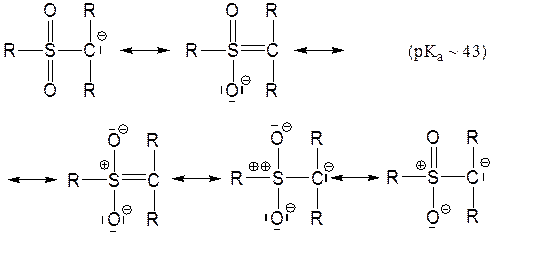
См. также Марч, т. 1, стр. 231; Реутов, т. 1, стр. 290-291; Днепровский, стр. 75-76, 165.
4. Эффект поля
Большинство групп, стабилизирующих КА за счет резонанса, стабилизируют их также благодаря электроноакцепторному эффекту поля путем оттягивания (делокализации) отрицательного заряда:
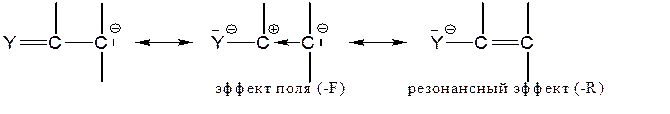
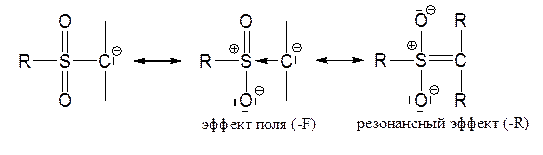
Часто оба эффекта, −R и −F, действуют одновременно, и отделить их друг от друга затруднительно.
Эффект поля стабилизирует КА и в тех случаях, если гетероатом (O, N, S) в α-положении к КА-центру в одной из дающих существенный вклад резонансных структур несет положительный заряд:
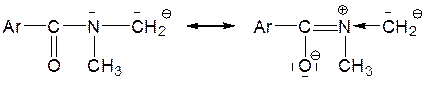
В илидах азота (илиды – биполярные (цвиттер-) ионы, в которых КА-центр соседствует с положительно заряженным) действует только эффект поля, благодаря чему они более устойчивы, чем соответствующие им простые карбанионы:
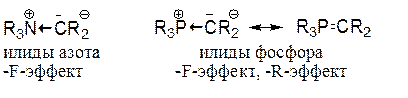
В отличие от илидов азота в илидах фосфора возможна и стабилизация за счет эффекта поля, и стабилизация резонансом.
5. Стабилизация благодаря ароматическому характеру карбаниона:
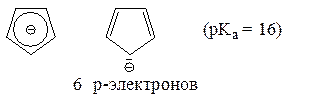
В целом, стабилизирующий эффект функциональных групп, находящихся в α-положении по отношению к карбанионному центру, убывает в следующем ряду:
NO2 > RC(O) > C(O)OR > RSO2 > CN ≈ C(O)NH2 > Hal > H > R.
В растворах карбанионы существуют либо в виде ионных пар, т. е. связаны (координированы) с противокатионом, либо в виде сольватированных частиц, т. е. частиц, связанных ион-дипольным взаимодействием с окружающими их молекулами растворителя. В высокополярных апротонных растворителях (диполярных апротонных растворителях типа ДМСО (диметилсульфоксид), ДМФА (диметилформамид), ГМФТА (гексаметилфосфортриамид, гексаметапол) карбанионы могут существовать в «обнаженном» виде, так называемые «свободные» карбанионы.
Ионная пара:
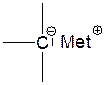
Ионная пара, разделенная растворителем:
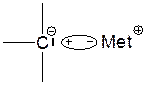
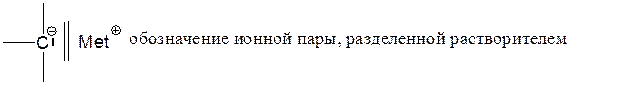
Сольватированный анион:
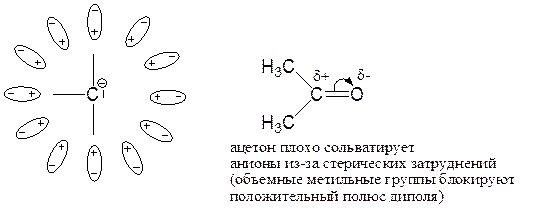
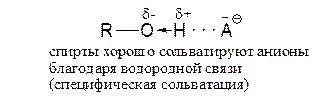
ДМСО (диметилсульфоксид):
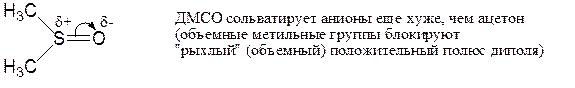
ДМФА (диметилформамид):
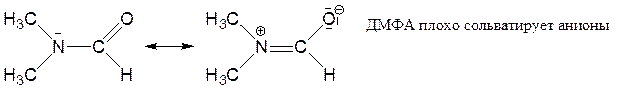
ГМФТА (гексаметилфосфортриамид, гексаметапол):
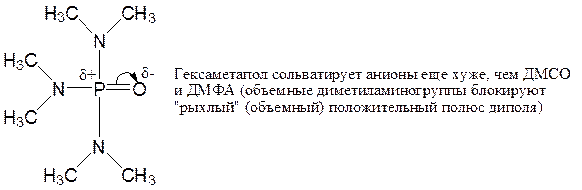
 2014-02-02
2014-02-02 3247
3247








