Хотя можно представить, что RR образуется следующим образом:
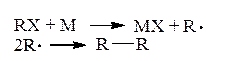
где М – металл,
но все же основной реакционный поток протекает по другому пути:
(1)
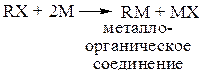
Эта стадия протекает следующим образом:
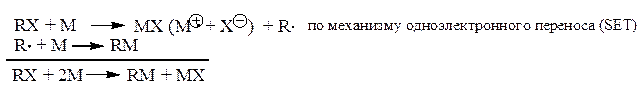
(2)
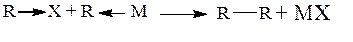
Эта реакция может рассматриваться одновременно и как SN2-, и как SE2-замещение, а также как «синхронный» четырехцентровой процесс (Пальм, стр. 315-316):
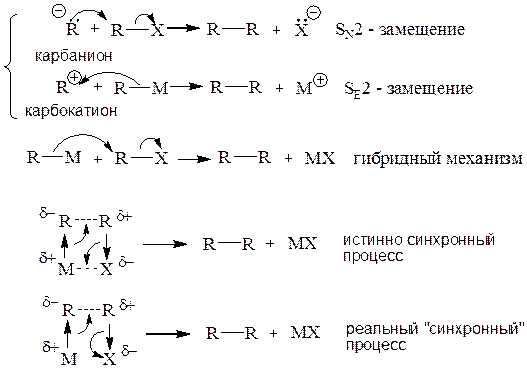
Истинно синхронный механизм предполагает образование ковалентной связи между металлом М и галогеном Х. Однако процесс типа SE2–SN2, когда противоположные заряды возникающих ионов М+ и Х- в активированном состоянии расположены рядом и электростатически стабилизируют друг друга, что равносильно частичному возникновению ионной связи – также можно назвать «синхронным».
(3) Побочно может протекать диспропорционирование:
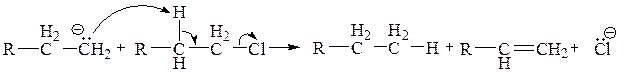
Фактически олефин RCH=CH2 образуется из субстрата RCH2CH2Cl в результате Е2-элиминирования под действием основания RСH2CH2y.
г) Катализируемая основаниями реакция Манниха
Реакция Манниха – это реакция аминометилирования. В качестве аминокомпонента используют вторичные и первичные алифатические и ароматические амины, в качестве метиленового компонента – формальдегид (в виде водного раствора – формалина или в виде параформа), реже – ацетальдегид. В качестве аминометилирующего агента может использоваться заранее приготовленный аминаль.
В качестве катализирующего реакцию основания может выступать сам аминокомпонент.
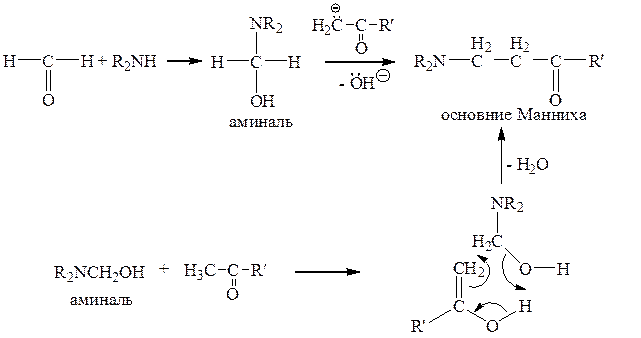
СН-кислота может вступать в реакцию аминометилирования также в енольной форме, с образованием циклического переходного состояния.
В кислых средах аминометилирование протекает по другому механизму, с участием высоко реакционноспособного интермедиата – карбений-иммониевого иона, являющегося азотистым аналогом формальдегида (здесь этот механизм не рассматривается; подробно см. Беккер, с. 301-302, 394-395; «Практикум», Беккер, с. 150-155; Марч, т. 3, с. 344-347).
3) Присоединение по двойным связям (обычно С=О)
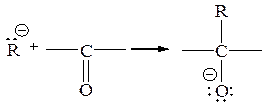
К этому типу реакций карбанионов относится целая группа синтетически важных реакций:
а) Ацилирование сложных эфиров сложными эфирами (конденсация Кляйзена)
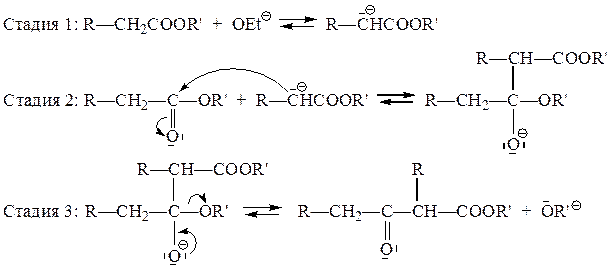
б) Альдольная конденсация и другие аналогичные реакции
Катализируемая основаниями альдольная конденсация основана на способности карбонильного соединения реагировать как в качестве карбокислоты (карбаниона, т. е. нуклеофила) за счет кислых a-С–Н-водородов, так и в качестве электрофила за счет электрофильного карбонильного углерода.
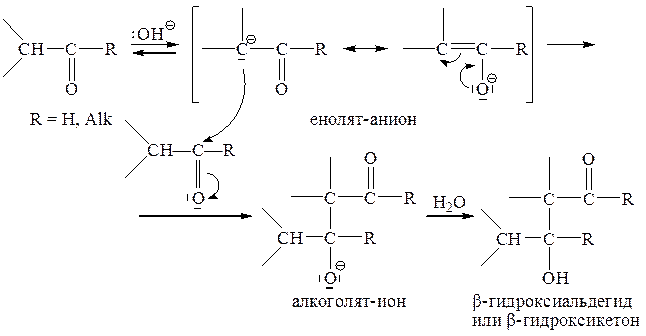
На последней стадии образовавшийся алкоголят-ион отрывает протон от ранее образовавшегося протонированного основания (или от растворителя), переходя в незаряженный продукт конденсации (b-гидроксиальдегид или b-гидроксикетон), при этом регенерируется катализатор (гидроксид-ион). Предпосылкой для осуществления этой стадии «нейтрализации» является более высокая основность алкоголят-иона (рКа 17-19) по сравнению с гидроксид-ионом (рКа 15,7). Если же оснόвный катализатор имеет более высокую основность, чем алкоголят-ион, то стадия «нейтрализации» не может осуществиться, и для конденсации необходимо применять эквимолярное количество основания. Пример такой конденсации будет рассмотрен позднее.
Если получающееся b-гидроксикарбонильное соединение все еще содержит кислый a-С–Н-водород, то в сильно щелочной водной среде оно также способно образовать соответствующий карбанион, который может присоединяться к молекуле исходного карбонильного соединения и т. д. [Сайкс, с. 117-118]. С другой стороны, поскольку оно содержит карбонильную группу, то может присоединять карбанион исходного соединения. В результате при действии сильного основания на такие альдегиды, как, например, ацетальдегид, образуются низкомолекулярные полимеры. Реакцию можно остановить после первого «простого» присоединения, используя слабые основания, например, карбонат калия.
Реакции альдольной конденсации могут осложняться процессом «кротонизации» (кротоновой конденсации). В цвиттер-ионной таутомерной форме b-гидроксикарбонильного соединения возникает обстановка сильного выталкивания с участием двойной связи в качестве проводника электронного смещения [Пальм, с. 377]:
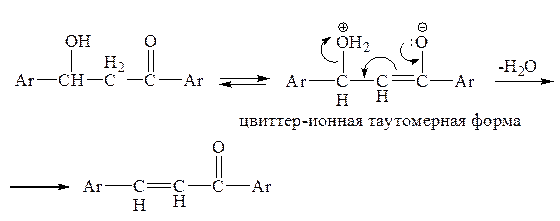
В образующемся ненасыщенном карбонильном соединении двойная связь сопряжена с карбонильной группой, и это в некоторой степени способствует его образованию. Однако реакция кротонизации особенно характерна для систем с ароматическими заместителями, поскольку как цвиттер-ион, так и активированный комплекс, напоминающий продукт реакции, стабилизированы сопряжением двойной связи с p-электронной системой ароматического ядра. Результат реакции эквивалентен дегидратации соответствующего b-гидроксикетона (или альдегида).
Следует отметить, что дегидратация, вызванная действием основания – редкое явление. Как правило, отщепление молекулы воды протекает в условиях кислотного катализа.
Предложен и другой механизм кротонизации, предполагающий ее протекание через карбанион b-гидроксикарбонильного соединения [Сайкс, с. 118]:
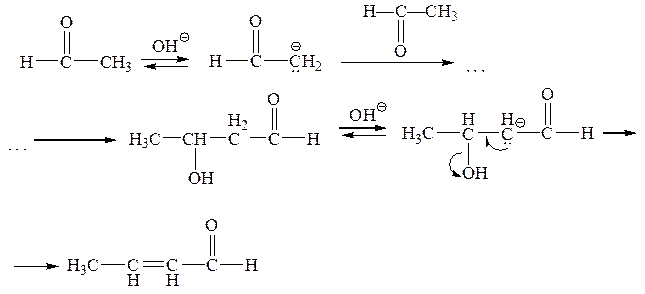
Смешанные реакции альдольной конденсации, например, реакции с двумя разными альдегидами, обычно не имеют практического значения, поскольку при взаимодействии двух альдегидов с двумя полученными из них анионами образуется смесь четырех различных продуктов. Однако некоторые «смешанные» альдольные реакции могут представлять практический интерес в том случае, если один из карбонильных компонентов, например, бензальдегид, не может образовывать карбанион, а поэтому может только присоединять карбанион, генерированный из другого карбонильного компонента. Пример такой реакции приведен выше, при рассмотрении механизма кротонизации по Пальму. К этому типу реакций относится также реакция альдольной конденсации (с кротонизацией) ацетальдегида с бензальдегидом:
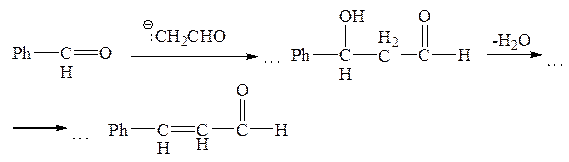
Обычная альдольная конденсация (т. е. несмешанная) невозможна для альдегидов, не имеющих a-С–Н-связей, а именно: для формальдегида HCHO, бензальдегида PhCHO или R3CCHO – и поэтому не способных образовывать карбанионы обсуждаемого типа. При взаимодействии любого из таких альдегидов с водным раствором основания гидроксильный ион просто присоединяется к карбонильной группе. Однако при использовании сильного основания в больших концентрациях такие альдегиды подвергаются окислительно-восстановительному диспропорционированию (реакция Канницаро), когда из двух молекул альдегида одна окисляется до соответствующей кислоты (в виде аниона), а другая восстанавливается до соответствующего спирта:
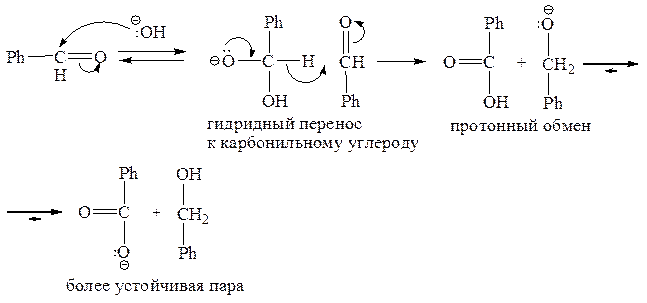
Поскольку формальдегид вследствие большой электроотрицательности карбонильной группы все же является карбокислотой, то он способен к своеобразной альдольной конденсации в щелочной среде:
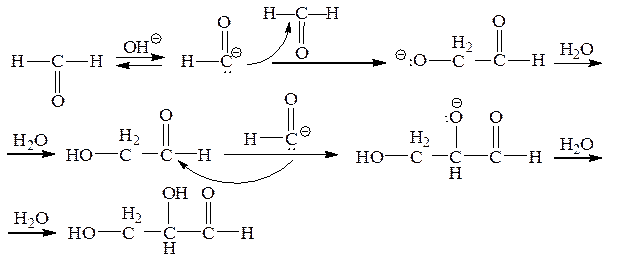
Таким путем образуются полигидроксиальдегиды и кетоны, в том числе представители класса моносахаридов.
Если карбонильной компонентой, реагирующей с C–H-кислотным карбонильным соединением, является производное карбоновой кислоты (сложный эфир, ангидрид, галогенангидрид), то обязательно происходит конденсация наподобие кротоновой, только отщепляется спирт, карбоновая кислота или гидрогалогенид, соответственно. В результате получаются резонансно-стабилизированные анионы (еноляты) b-дикарбонильных соединений:
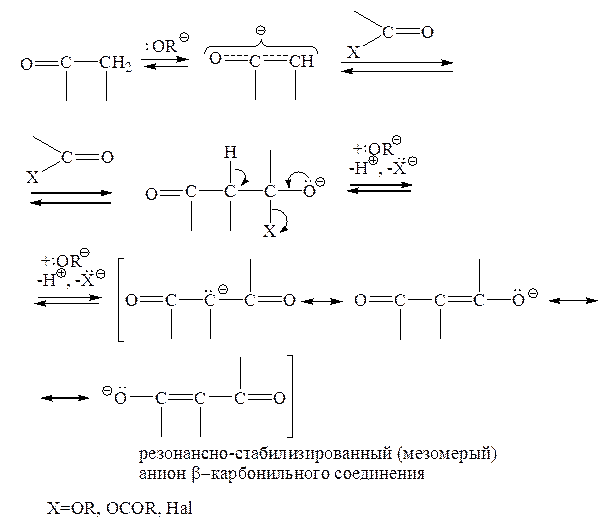
Вследствие своей небольшой основности анионы b-дикарбонильных соединений, как правило, не способны регенерировать из протонированного оснόвного «катализатора» свободное основание (например, алкоголят-ион), поэтому необходимо использовать эквимолярное количество основного агента. Если же X=OCOR или Hal, то необходим еще один моль основания; таким образом в таких случаях всего берут два моля основания: 1 моль – чтобы генерировать анион С–Н-кислотного карбонильного соединения, и еще 1 моль – чтобы нейтрализовать выделяющуюся кислоту RCOOH или HHal.
Необходимо отметить, что альдольная конденсация может протекать также по кислотно-каталитическому механизму:
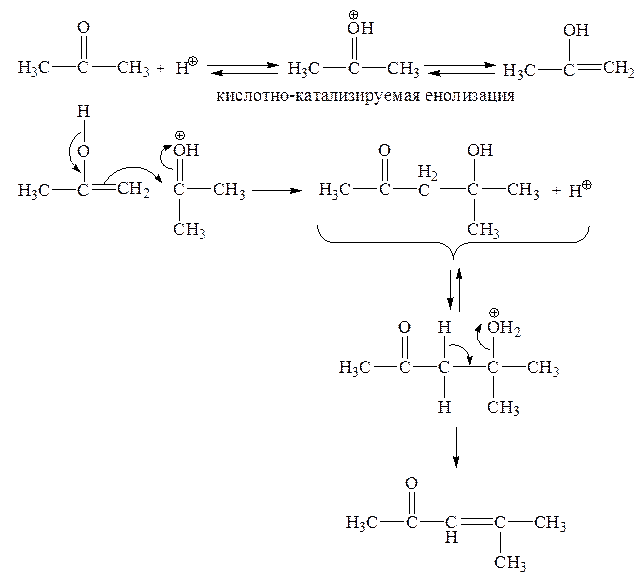
В качестве катализаторов могут выступать как протонные кислоты, так и кислоты Льюса (например, BF3). Кислотный катализатор повышает карбонильную активность и, кроме того, катализирует енолизацию кислотной компоненты. Енол благодаря оснόвным свойствам двойной связи атакует карбонильную группу как нуклеофильный реагент. Однако в кислой среде образовавшийся альдоль немедленно дегидратируется, т. е. в итоге происходит кротоновая конденсация.
Можно предположить и синхронный механизм кислотно-катализируемой альдольной конденсации с циклическим переходным состоянием:
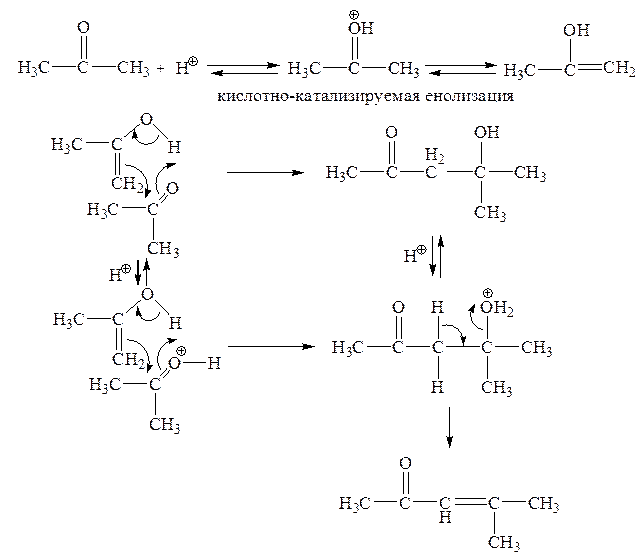
в) Присоединение металоорганических соединений (магнийорганических соединений) к альдегидам и кетонам, производным карбоновых кислот
(i) Присоединение к альдегидам и кетонам:
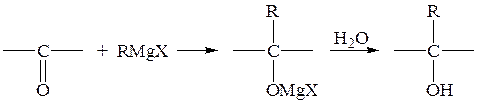
(ii) к производным карбоновых кислот:
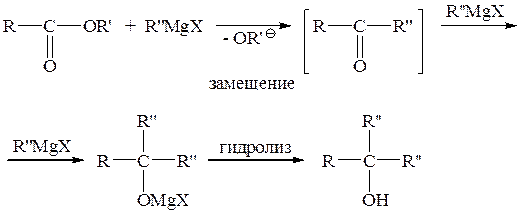
г) Конденсация Кновенагеля
Механизм этой реакции, протекающей через стадии присоединения-дегидратации, аналогичен механизму кротоновой конденсации (см. п. 3-(3) (б)).
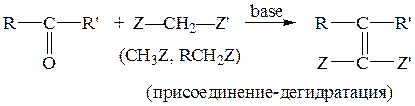
Пример:
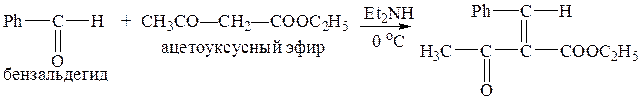
д) Реакция Нефа (с ацетиленовыми карбанионами)
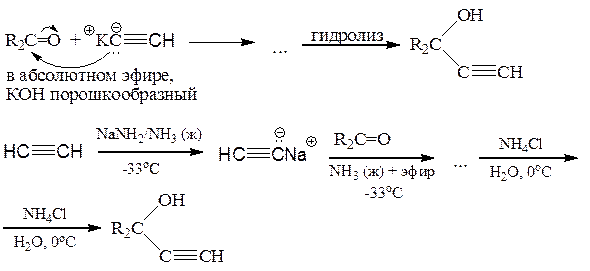
См. также Реутов, т. 1, стр. 490-491.
 2014-02-02
2014-02-02 12163
12163
