СВОБОДНЫЕ РАДИКАЛЫ
Свободный радикал (СР) – это частица, содержащая один или несколько неспаренных электронов.
Такое определение включает некоторые неорганические молекулы, например, NO, NO2, а также многие индивидуальные атомы, например, Na, Cl.
Радикалы (Р) обладают магнитным моментом и являются парамагнитными частицами. Детектируются обычно методом электронного спинного резонанса (ЭСР), который называют также методом электронного парамагнитного резонанса (ЭПР). В принципе этот метод аналогичен методу ЯМР.
Удается получить спектры Р со временем жизни меньше одной секунды. Если концентрация Р слишком мала, то применяют метод спиновой ловушки, заключающийся в добавлении такого соединения, которое, взаимодействуя с очень реакционноспособными Р, образует более стабильные Р, регистрируемые с помощью ЭПР:
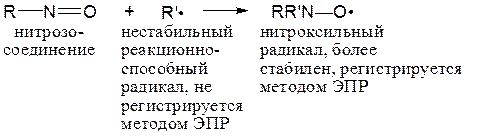
СР могут быть детектированы с помощью обычного спектрометра ЯМР, используя явление химической индукции динамической поляризации ядер (ХИДПЯ).
Порядок устойчивости СР такой же, как и в случае карбокатионов:
третичные > вторичные > первичные.
Как и в случае КК, этот ряд объясняется гиперконьюгацией:
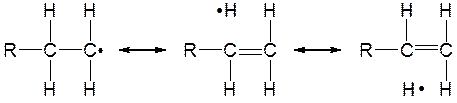
Бензильные и аллильные радикалы, благодаря резонансу, устойчивее простых, но и они существуют только как промежуточные частицы:
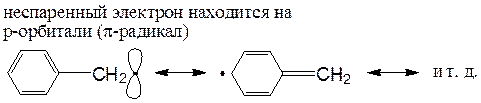
Однако такие Р, как трифенилметильный радикал, сохраняются в растворе при комнатной температуре, правда, в равновесии с димерной формой:
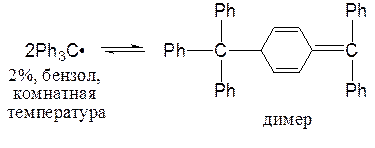
В случае Р трифенилметильного типа главной причиной устойчивости является не резонансная стабилизация, а стерические затруднения димеризации.
Радикал Ph3C• не является плоским, а имеет форму пропеллера (см. лекцию 18, трифенилметильный катион).
Еще более устойчивы полностью хлорированные трифенилметильные радикалы, по-видимому, по стерическим причинам. Они инертны в растворах и в твердом состоянии.
Известны очень устойчивые Р, в которых неспаренный электрон находится на гетероатоме:
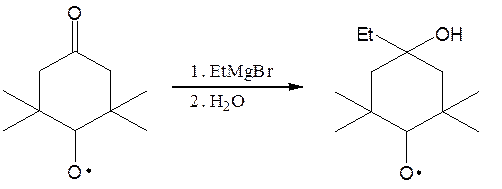
Мерой относительной устойчивости СР служит энергия диссоциации (D) связи R−H: чем выше величина D, тем менее устойчив радикал.
| Радикал | Ph• | Me• | Et• | CCl3• | Me2CH• | Me3C• | CH2=CH−CH2• | PhCH2• |
| D, ккал/моль | 110 | 104 | 98 | 96 | 95 | 92 | 89 | 85 |
Для простых алкильных радикалов возможны два типа структур:
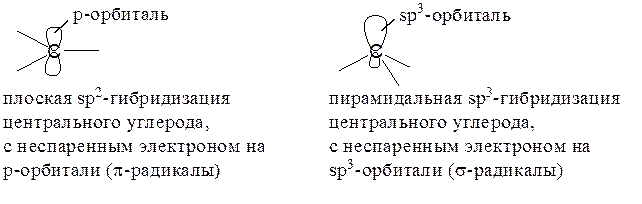
Химические данные и физические эксперименты (ЭПР, УФ-, ИК-спектры) свидетельствуют в пользу плоской или почти плоской структуры, однако разность энергий плоских и пирамидальных радикалов невелика.
СР типа CF3• предпочитают низкую пирамидальную форму, с очень малым барьером инверсии; чем выше электроотрицательность соседнего с радикальным центром атома, тем больше отклонение от планарности.
Резонансно стабилизированные свободные радикалы имеют плоскую форму, хотя, как у же было отмечено выше, радикалы трифенилметильного типа Ar3C•, подобно соответствующим карбокатионам, имеют форму пропеллера.
 2014-02-02
2014-02-02 3111
3111








