Свойства растворов электролитов. Теория электролитической диссоциации Аррениуса. Закон разведения Оствальда. Понятие об электролитической теории Дебая-Гюккеля. Активность и коэффициент активности электролитов. Средняя ионная активность и средний ионный коэффициент активности. Правило ионной силы.
ЛЕКЦИЯ 7
Электрохимия – раздел физической химии, изучающий связь между химическими процессами и электрическими явлениями.
По способности проводить электрический ток растворы можно подразделить на два класса – электролиты и неэлектролиты
Электролиты – это вещества, которые в растворе и в расплаве диссоциируют на ионы и проводят электрический ток. Сюда же относятся и твердые электролиты.
В 1883 году С. Аррениус сформулировал основные положения теории о физической природе электролитов, которые получили название теории электролитической диссоциации Аррениуса.
1. Молекулы электролита подвергаются в растворах диссоциации на катионы и анионы.
2. Диссоциация может быть полной или частичной. она характеризуется степенью диссоциации α.
|
|
|
3. По способности к диссоциации электролиты были разделены на слабые и сильные.
– сильные электролиты - вещества, полностью диссоциирующие в растворе (α ≈ 1).
– слабые электролиты - вещества, диссоциирующие в растворе лишь частично (α < 1).
4. Согласно теории диссоциации Аррениуса взаимодействие между ионами отсутствует (как в идеальном газе). На самом деле молекулы, образовавшиеся при диссоциации, и ионы находятся в равновесии между собой. Процесс диссоциации обратим. Причина диссоциации ‑ это
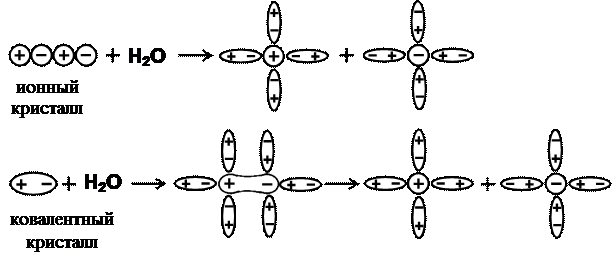 |
взаимодействие растворенного вещества с молекулами растворителя (рис. 1).
Рис. 1.
 |
Электропроводность слабых электролитов определяется степенью диссоциации (a), величина которой зависит от концентрации электролита и температуры (рис. 2).
Рис. 2.
Степень диссоциации – это отношение числа частиц (молекул), растворившихся на ионы к числу растворенных частиц (молекул).
α ≤ 1
По величине степени диссоциации судить о силе электролита не очень удобно, так как величина  зависит от многих параметров, особенно от концентрации. Более удобно использовать величину константы диссоциации Кд (Кравновесия).
зависит от многих параметров, особенно от концентрации. Более удобно использовать величину константы диссоциации Кд (Кравновесия).
Рассмотрим равновесие диссоциации слабого бинарного электролита, например,
 .
.
Пусть С0 - начальная концентрация СН3СООН, тогда
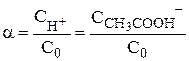 ,
,
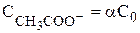 ,
, 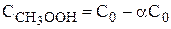 .
.
Запишем константу диссоциации:
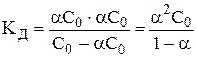 . (1)
. (1)
Выражение (1) называют законом разведения Оствальда для бинарных электролитов. Для более сложных электролитов выражение для КД, будет иметь иной вид.
Как любая константа равновесия, константа диссоциации зависит от температуры, поэтому сила электролита меняется с изменением температуры.
|
|
|
Для описания коллигативных свойств растворов электролитов используют изотонический коэффициент.
Изотонический коэффициент (i) - это отношение числа всех частиц в растворе к числу растворенных частиц.
i ≥ 1. (2)
Изотонический коэффициент показывает, во сколько раз суммарная эффективная концентрация недиссоциированных молекул и ионов в растворе больше начальной концентрации молекул до диссоциации. С ростом концентрации коэффициент 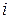 уменьшается.
уменьшается.
Рассмотрим как связаны 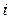 и
и 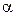 . Пусть ν – число ионов, на которые распадается частица (молекула) тогда
. Пусть ν – число ионов, на которые распадается частица (молекула) тогда 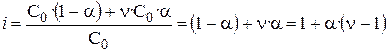 , (3)
, (3)
Если α = 0 (неэлектролит), то i = 1,
если α = 1 (сильный электролит), то, например, для NaCl i = 2.
Экспериментально величину i можно найти путем сравнения опытных значений осмотических давлений растворов, значений понижения температуры замерзания или повышения температуры кипения растворов со значениями, вычисленными в предположении, что i = 1 (расчетные величины):
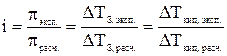 . (4)
. (4)
Следует помнить, что i ≥ 1 для растворов электролитов (они диссоциируют), если же молекулы в растворе ассоциируют (например, из двух молекул образуется одна частица за счёт водородных связей), то i < 1.
 2014-02-02
2014-02-02 3731
3731