Биохимические маркеры синтеза коллагена
Болезни, связанные с нарушением деградации коллагена
• увеличенная активность коллагеназы обнаружена в суставах при ревматоидном артрите, в тканях ротовой полости при периодонтите, при ряде кожных заболеваний, язвенных кератитах. Коллагенолитическая активность увеличивается при воспалении, в опухолях, в заживающих ранах.
• Недостаточность активности коллагеназы отмечается при циррозе печени, склеродермии, легочном фиброзе и др.
• Производные коллагена N и С-пропептиды
• Пролил- и лизилгидроксилаза
• Фибронектин
• Щелочная фосфатаза (костный изофермент)
• Производные коллагена N и С-пропептиды
• Гидроксипролин
• Пиридинолин
• ГАГ
• ГГЛ (галактозил-гидроксилизин)
• ГГГЛ (глюкозил-ГГЛ)
• Коллагеназа, эластаза
• Кислая фосфатаза
ЭЛАСТИН – второй главный белок соединительной ткани.
• Различия с коллагеном. В свойствах. Эластин в отличие от коллагена не образует при кипячении желатину. В локализации. Коллаген – главный белок белой соединительной ткани, а эластин – жёлтой. Эластин преобладает в эластичных структурах (стенки больших кровеносных сосудов…), а в образовании рубцов, наоборот, участвует коллаген.
• Аминокислотный состав тоже отличается от коллагена: хотя много глицина и пролина, отсутствуют гидроксипролин и гидроксилизин. Эластин особенно богат нейтральными алифатическими аминокислотами (вал, лей и иле, ала), а полярных заряженных аминокислот (глу, арг) мало.
• Строение. Волокна эластина построены из относительно небольших почти сферических молекул, соединенных в волокнистые тяжи с помощью жестких поперечных сшивок.
Всего имеется 2 основных формы поперечных сшивок, обе с участием лизина.
1). Из четырех остатков лизина образуются: десмозин и изодесмозин.
Структура их довольно необычна: четыре остатка лизина, соединяясь боковыми радикалами, образуют замещенное пиридиновое кольцо. Считают, что при образовании десмозина сначала три остатка лизина окисляются лизилоксидазой до ε-альдегидов (аллизин), а затем соединяются с четвертым остатком лизина.
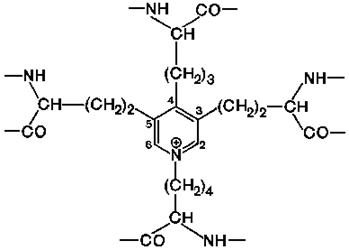
Эти остатки лизина находятся на двух соседних цепях или принадлежат трём или четырём разным цепям. Этим можно объяснить, что эластин в отличие от других фибриллярных белков способен растягиваться в двух направлениях. Поперечные сшивки очень прочные, так что даже кислота не может их гидролизовать.
 2014-02-02
2014-02-02 4432
4432
