Кинетический контроль
Если реакция протекает необратимо, а ее продукты стабильны и не расходуются далее, то соотношение выходов продуктов (отношение концентраций продуктов в реакционной смеси) определяется отношением констант скоростей их образования, т.е. разностью значений свободных энергий активации, соответствующих переходным состояниям Т1 и Т2 (DGактив.). При этом говорят, что соотношение продуктов подчиняется кинетическому контролю или что состав продуктов контролируется кинетически.
Если реакции образования продуктов обратимы, но скорость образования продуктов П1 и П2 значительно выше, чем скорость достижения равновесия между ними (время, необходимое для достижения равновесия, существенно больше, чем время проведения реакции и выделения ее продуктов), то реакция также подчиняется кинетическому контролю.
Если реакции, приводящие к продуктам П1 и П2, обратимы, а скорость достижения равновесия между ними соизмерима со скоростями образования продуктов (превращения исходных соединений), то через некоторое время после начала химического взаимодействия соотношение продуктов П1 и П2 будет определяться разностью их свободных энергий продуктов DG, т. е. их относительной термодинамической стабильностью. Если обратимо только образование П1, а реакция образования продукта П2 практически необратима, то с течением времени весь продукт П1 перейдет в П2.
Если скорость установления равновесия между продуктами П1 и П2 меньше, чем скорость их образования, но реакционная смесь выдерживается длительное время, то первоначальное соотношение продуктов будет подчиняться кинетическому контролю, а затем постепенно система придет к состоянию равновесия, т. е. установится термодинамический контроль состава продуктов реакции.
При повышении температуры, благодаря существенному увеличению скоростей обратных реакций, достижение состояния равновесия ускоряется. Таким образом, при повышении температуры может произойти переход от кинетического контроля к термодинамическому контролю:
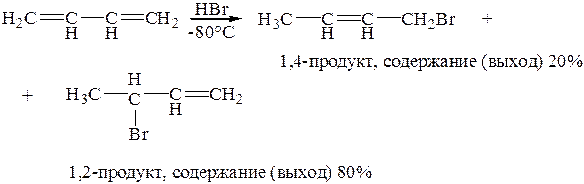
При высоких температурах содержание 1,4-продукта увеличивается до 80%, что соответствует его равновесному содержанию.
Вероятность термодинамического контроля тем больше, чем в меньшей степени продукты П1 и П2 отличаются по энергиям от переходных состояний Т1 и Т2.
Подобным образом конкурирующее присоединение к сопряженным системам может осуществляться не только по электрофильному механизму, но и по любому из трех других возможных механизмов присоединения: нуклеофильному, радикальному или синхронному, причем в первых двух случаях конкуренция 1,2- и 1,4-присоединения возникает благодаря резонансной стабилизации зарядов или радикальных центров в аллильном карбанионе или аллильном радикале, образующемся в результате атаки Yy или R× по концевому (терминальному) углероду сопряженной системы:
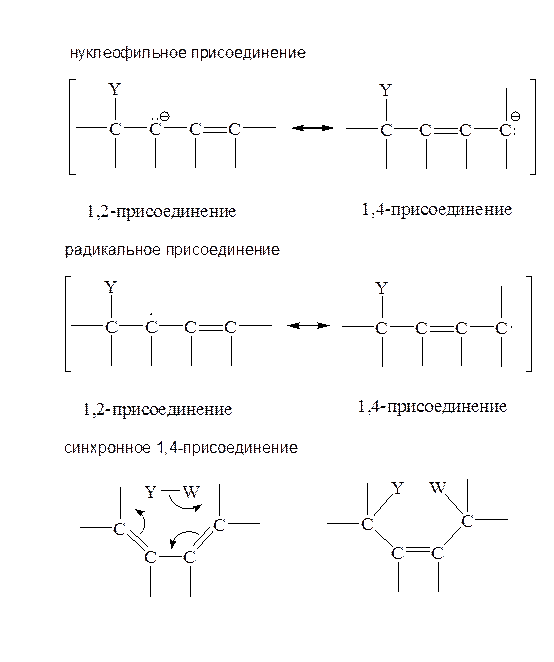
 2014-02-02
2014-02-02 1272
1272