Рисунок 16
 Это уравнение полностью определяет поведение электрона в атоме водорода.
Это уравнение полностью определяет поведение электрона в атоме водорода.
Можно показать, что уравнение имеет требуемые однозначные, конечные и непрерывные решения в следующих случаях: 1) при любых положительных Е; 2) при дискретных отрицательных значениях энергии, равных
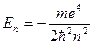 ,
, 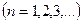 .
.
Преимущество записи уравнения Шредингера в сферических координатах при решении задачи об атоме водорода заключается в том, что в таком виде его легко разделить на три уравнения, каждое из которых зависит только от одной координаты.
Будем искать решения, в которых волновая функция 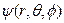 является произведением трёх различных функций: R(r), зависящей только от r,
является произведением трёх различных функций: R(r), зависящей только от r, 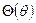 , зависящей только от
, зависящей только от 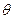 , и
, и 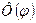 , зависящей только от
, зависящей только от 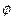 . Функция R(r) характеризует изменение волновой функции электрона вдоль радиуса – вектора при постоянных q и j; Функция Q(q) описывает изменения y в зависимости от зенитного угла q вдоль меридиана на сфере, центром которой служит ядро, при постоянных r и j. Функция
. Функция R(r) характеризует изменение волновой функции электрона вдоль радиуса – вектора при постоянных q и j; Функция Q(q) описывает изменения y в зависимости от зенитного угла q вдоль меридиана на сфере, центром которой служит ядро, при постоянных r и j. Функция 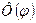 характеризует изменение y в зависимости от азимутального угла j.
характеризует изменение y в зависимости от азимутального угла j.
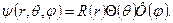
Окончательно находим:
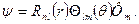
Параметр 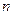 , называемый главным квантовым числом, совпадает с номером уровня энергии. Параметры
, называемый главным квантовым числом, совпадает с номером уровня энергии. Параметры 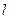 и
и 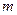 представляют собой азимутальное и магнитное квантовые числа, определяющие по формулам
представляют собой азимутальное и магнитное квантовые числа, определяющие по формулам
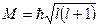 ,
, 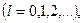
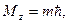
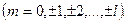
Модуль момента импульса и проекцию момента на некоторое направление 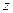 .
.
Выражение 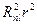 представляет собой плотность вероятности нахождения электрона на расстоянии
представляет собой плотность вероятности нахождения электрона на расстоянии 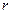 от ядра:
от ядра:
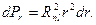
В связи с существованием спина электрона к указанным квантовым числам нужно добавить квантовое число 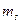 , которое может принимать значения
, которое может принимать значения  и определяет проекцию спина на заданное направление.
и определяет проекцию спина на заданное направление.
Согласно принципу Паули в одном и том же атоме (или в какой-либо другой квантовой системе) не может быть двух электронов, обладающих одинаковой совокупностью квантовых чисел. Иными словами, в одном и том же состоянии не могут находиться одновременно два электрона.
Вопросы для самоконтроля
1) Что представляют собой спектр испускания и поглощения водорода.
2) В чем заключается спектральный анализ как важнейший метод химического анализа.
3) С какой целью Резерфорд проводил эксперименты по рассеянию альфа-частиц.
4) В чем заключается теория атома водорода по Бору.
5) Что называется принципом неопределенностей Гейзенберга.
6) Какие операторы в квантовой механике вы знаете.
7). Запишите уравнения Шредингера для атома водорода.
8) В чем заключается квантовая теория атома водорода.
9) Какие квантовые числа вы знаете
10) Сформулируйте принцип Паули.
СПИСОК ЛИТЕРАТУРЫ
Основная
1. Детлаф, А.А. Курс физики учеб. пособие / А.А. Детлаф, Б.М. Яворский.-7-е изд. Стер.-М.: ИЦ «Академия».-2008.-720 с.
2. Савельев, И.В. Курс физики: в 3т.: Т.2: Электричество. Колебания и волны. Волновая оптика / И.В. Савельев.-4-е изд. стер. – СПб.; М. Краснодар: Лань.-2008.- 480 с.
3. Трофимова, Т.И. курс физики: учеб. пособие/ Т.И. Трофимова.- 15-е изд., стер.- М.: ИЦ «Академия», 2007.-560 с.
Дополнительная
1. Фейнман, Р. Фейнмановские лекции по физике / Р. Фейнман, Р. Лейтон, М. Сэндс.– М.: Мир.
Т.1. Современная наука о природе. Законы механики. – 1965. –232 с.
Т. 2. Пространство, время, движение. – 1965. – 168 с.
Т. 3. Излучение. Волны. Кванты. – 1965. – 240 с.
2. Берклеевский курс физики. Т.1,2,3. – М.: Наука, 1984
Т. 1. Китель, Ч. Механика / Ч. Китель, У. Найт, М. Рудерман. – 480 с.
Т. 2. Парселл, Э. Электричество и магнетизм / Э. Парселл. – 448 с.
Т. 3. Крауфорд, Ф. Волны / Ф. Крауфорд – 512 с.
3. Фриш, С.Э. Курс общей физики: в 3 т.: учеб. / С.Э. Фриш, А.В. Тиморева.- СПб.: М.; Краснодар: Лань.-2009.
Т. 1. Физические основы механики. Молекулярная физика. Колебания и волны: учебник - 480 с.
Т.2: Электрические и электромагнитные явления: учебник. – 518 с.
Т. 3. Оптика. Атомная физика: учебник– 656 с.
 2014-02-02
2014-02-02 587
587








