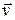ЭЛЕМЕНТЫ КВАНТОВОЙ ФИЗИКИ АТОМОВ, МОЛЕКУЛ И ТВЕРДЫХ ТЕЛ
Лекция 5
Спектры атомов подразделяют на спектры испускания и спектры поглощения. Для получения спектра испускания водорода его необходимо разогреть до высокой температуры и излучение пропустить через оптическую систему, состоящую из коллиматора и призмы. При этом на экране, размещенном за призмой, можно наблюдать тонкие цветные линии, образующие спектральную серию, называемую серией Бальмера. Частоты 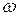 спектральных линий серии Бальмера определяются из формулы:
спектральных линий серии Бальмера определяются из формулы:
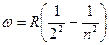 ,
, 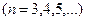 ,
,
где 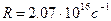 - постоянная Ридберга. Кроме одной спектральной серии, расположенной в видимой части спектра, у водорода имеется одна спектральная серия в ультрафиолете, называемая серией Лаймана:
- постоянная Ридберга. Кроме одной спектральной серии, расположенной в видимой части спектра, у водорода имеется одна спектральная серия в ультрафиолете, называемая серией Лаймана:

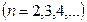 ,
,
а также спектральные серии в инфракрасной части спектра:
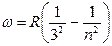 ,
, 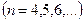 , (серия Пашена),
, (серия Пашена),

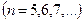 , (серия Брэкета),
, (серия Брэкета),
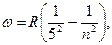
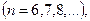 (серия Пфунда).
(серия Пфунда).
В низкочастотной области спектр атома водорода простирается вплоть до радиодиапазона. В настоящее время в спектре межзвездного водорода обнаружены спектральные линии, соответствующие длинам волн 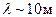 . Если обратить внимание на структуру соотношений (6.1)-(6.5), то видно, что все они могут быть представлены в общем виде:
. Если обратить внимание на структуру соотношений (6.1)-(6.5), то видно, что все они могут быть представлены в общем виде:
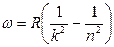 ,
,
где 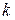 и
и 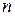 целые числа, причем
целые числа, причем 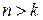 . Соотношение называют обобщенной формулой Бальмера.
. Соотношение называют обобщенной формулой Бальмера.
Спектр поглощения водорода можно получить при пропускании через него электромагнитного излучения с непрерывным спектром. Тогда после прохождения через коллиматор и призму излучение на экране разворачивается в спектр, представляющий собой радугу на фоне которой заметны тонкие черные полоски. Черным полоскам соответствуют частоты, определяемые формулой. Таким образом, спектр излучения и спектр поглощения водорода взаимно дополняют друг друга до радуги.
Атом каждого химического элемента обладает своим уникальным спектром. Поэтому на анализе спектрального состава излучения основан важнейший метод химического анализа. Наличие в смеси того или иного химического элемента может быть установлено по присутствию в спектре излучения его характерных спектральных линий. Оказывается, что из анализа спектральных линий может быть получена и другая важная информация. Так по ширине и интенсивности спектральных линий можно судить о температуре и концентрации вещества в смеси. Спектральный анализ особенно широко применяется в астрофизике поскольку вещество удаленных космических объектов недоступно для других методов химического анализа. В настоящее время исследование спектров излучения позволило установить химический состав звезд, межзвездной среды и целого ряда других космических объектов.
Изучение атомных спектров послужило ключом к пониманию строения атома. Оказалось, что все попытки объяснения особенностей атомных спектров в рамках классической физики не увенчались успехом. Удовлетворительная теория атома водорода, основанная на положениях, выходящих за рамки классических представлений, была создана в 1913 году датским физиком Нильсом Бором. Данная теория основана на следующих постулатах:
1. Электрон в атоме может находиться лишь на некоторых орбитах, называемых стационарными. Находясь на стационарной орбите электрон не излучает и не поглощает электромагнитную энергию.
2. При переходе с одной стационарной орбиты на другую электрон излучает или поглощает квант электромагнитной энергии равный разности энергий соответствующих стационарных состояний:
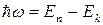 ,
,
 - постоянная Планка.
- постоянная Планка.
Из всех орбит электрона в атоме водорода оказываются возможными только те, на которых момент импульса электрона принимает значения целые кратные постоянной Планка:
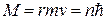 ,
, 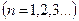 .
.
Определим радиусы 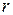 стационарных орбит. Для электрона, движущегося по круговой орбите вокруг протона, запишем второй закон Ньютона:
стационарных орбит. Для электрона, движущегося по круговой орбите вокруг протона, запишем второй закон Ньютона:
 ,
,
 -масса электрона,
-масса электрона, 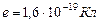 -заряд электрона,
-заряд электрона, 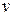 -скорость электрона,
-скорость электрона, 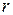 -радиус орбиты.
-радиус орбиты.
Используя боровское условие квантования, и исключая 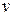 , находим:
, находим:
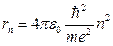 ,
, 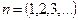 .
.
Энергия электрона, находящегося на орбите с номером 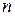 , определяется соотношением:
, определяется соотношением:
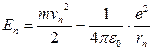 ,
,
 | |||
 | |||
|

|

 | |||||
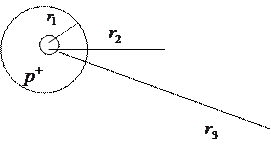 | |||||
 | |||||
а) б)
Рисунок 14. а) Атом водорода, б) Боровские орбиты электрона.
где первое слагаемое в правой части представляет собой кинетическую, а второе – потенциальную энергию взаимодействия электрона с ядром.
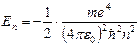 .
.
Используя второй постулат Бора, находим:
 .
.
Находим, что множитель, стоящий перед скобками в правой части, представляет собой постоянную Ридберга. Таким образом:
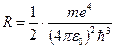 .
.
Теоретическое и экспериментальное значения 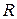 совпадают с высокой степенью точности, что свидетельствует о справедливости основных положений теории Бора.
совпадают с высокой степенью точности, что свидетельствует о справедливости основных положений теории Бора.
Становится очевидной также природа спектральных серий атома водорода. На рисунке схематически представлены энергетические уровни атома водорода. Серия Лаймана образована в результате излучения квантов электромагнитной энергии при переходе с более высоко лежащих энергетических уровней на уровень с 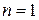 , серия Бальмера - при переходе на уровень с
, серия Бальмера - при переходе на уровень с 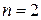 , серия Пашена – при переходе на уровень с
, серия Пашена – при переходе на уровень с 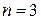 и т. д.
и т. д.
Спектр поглощения образуется при переходах электронов в атомах водорода снизу вверх. При этом электрон поглощает квант электромагнитной энергии и атом оказывается в возбужденном состоянии.
Объединенная формула Бальмера позволяет по известной частоте (длине волны) спектральной линии определить постоянную Ридберга:
 .
.
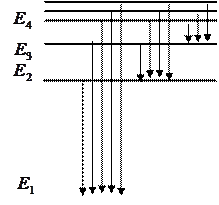
 2014-02-02
2014-02-02 13462
13462