Тема: Квантово-механическая модель атома. Квантовые числа. Принцип Паули. Электронные оболочки. Застройка электронных оболочек. Периодическая система элементов Д.И.Менделеева. Рентгеновские лучи.
Строение электронной орбитали и ее энергия взаимодействия с ядром атома определяются атомными квантовыми числами, которые являются целочисленными параметрами собственных функций уравнения Шредингера. Квантовые числа называются: главное, орбитальное, магнитное и спиновое.
Главное квантовое число n характеризует уровень энергии электрона и удаленность последнего от ядра атома. Сейчас известны следующие значения главных квантовых чисел и соответствующие им энергетические уровни атомов:
Главное квантовое число 1,2,3,4,5,6,7,8.
Энергетический уровень K, L, M, N, O, P, Q, R.
Энергия уровней возрастает с ростом главного квантового числа: наименьшим значением энергии обладает уровень К (n =1), ближайший к ядру атома.
Орбитальное квантовое число l определяет момент количества движения, электрона относительно ядра атома. Значения l изменяются от 0 до (n -1). Как и главное квантовое число n, орбитальное квантовое число тоже определяет энергию электрона, но уже в определенном энергетическом уровне. Следовательно, электроны с одинаковым n, но разным орбитальным квантовым числом, могут обладать различной энергией и занимать на одном и том же уровне различные энергетические подуровни. Однако разница энергий с n = 1 и n = 2 значительно больше, чем разница энергий подуровней с l =0 и l =1. В зависимости от величины l подуровни обозначаются такими буквами:
Значение l 0, I, 2, 3,. 4.
Обозначение подуровня s, p, d, f, g.
Самым главным свойством орбитального квантового числа является то, что оно определяет форму электронной орбитали, которая обозначается так же, как и подуровни.
Энергия связи электрона в атоме с ростом радиуса энергетического уровня, на котором он находится, очень быстро уменьшается, наиболее связанные с ядром будут электроны с минимальным n. С ростом l энергия электрона тоже уменьшается. Например,2sэлектрон связан с ядром атома крепче, чем 2р электрон.
Пока главное квантовое число мало, различия в энергии, вызванные изменением l, малы по сравнению с различиями, связанными с изменением n. Однако положение меняется, если n >3. Например, энергия орбитали 4s меньше энергии орбитали 3d.
Таким образом, квантовые числа n и l определяют энергию и форму электронных орбиталей.
Магнитное квантовое число me определяет момент количества движения электрона относительно внешнего электромагнитного поля. Оно может принимать значения от l до - l или всего (2 l + I) значений.
Количество магнитных квантовых чисел определяет число электронных орбиталей:
электронная орбиталь s, p, d, f, g.
величина l 0, I,2, 3, 4.
количество me = (2 l + I) I. 3. 5. 7. 9.
Расщепление энергетических уровней в магнитном поле обнаружено Земаном, а в электрическом поле Штарком.
Магнитное спиновое квантовое число ms. Спин характеризует собственный момент количества движения электрона вокруг своей оси. Существуют всего две независимые возможности такого вращения: против часовой стрелки и по часовой стрелке. Им отвечают два значения магнитного спинового квантового числа: ms = +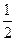 и ms= -
и ms= -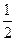 . Расщепление соответствующих уровней подтверждено в опытах О. Штерна и В. Герлаха.
. Расщепление соответствующих уровней подтверждено в опытах О. Штерна и В. Герлаха.
Значит, эти четыре квантовых числаn, l, me, ms определяют энергию и положение электрона в атоме.
 2014-02-02
2014-02-02 543
543








